玻恩-哈伯循环
引言
评估反应能量的一种方法是玻恩-哈伯循环。它由两位德国化学家弗里茨·哈伯和马克斯·玻恩于1919年创建,并以他们命名。它阐明并有助于理解离子化合物的形成方式。因为它无法直接测量晶格能,所以主要用于计算晶格能。玻恩-哈伯循环是将赫斯定律应用于离子分子形成过程中发生的标准焓变的方法。焓变是描述离子化合物晶格能的热力学量。
影响晶格能的因素
晶格能受以下因素影响:
晶体中的离子间距离,即当离子靠得更近时,它们之间的吸引力更强;以及
离子的电荷。
晶格能越大,离子靠得越近,它们的电荷越大。由于难以通过实验直接测定晶格能,我们采用了一种称为玻恩-哈伯循环的间接方法来获得晶格能。
构建玻恩-哈伯循环
玻恩-哈伯循环包含以下步骤:
(a) 必要时,将固态/液态反应物转化为气态。
(b) 气态阴离子和气态阳离子的形成。
c) 通过结合气态离子形成离子固体。让我们考虑MX(一种离子固体)的生成,其中M是碱金属,X是气态卤素。
$$\mathrm{M(s)+\frac{1}{2}X_2(g)\xrightarrow{\Delta H_f} MX (s)}$$
其中 $\mathrm{\Delta H_f}$ = MX 的形成焓
上述步骤可以进一步解释如下:
因为碱金属是固体,第一步是利用升华能 $\mathrm{(\Delta H_{sub})}$ 将1摩尔金属碱金属(M)转化为气态形式。
$$\mathrm{M^+(s)\xrightarrow{\Delta H_{sub}}M (g)}$$
这是一个吸热反应;因此其值为正。
卤素通常以双原子形式存在。另外,请注意,将1摩尔气态卤素分子解离为气态原子需要解离能 $\mathrm{(\Delta H_{diss})}$
$$\mathrm{X_2(g)\xrightarrow{\Delta H_{diss}}2X (g)}$$
这是一个吸热过程,因此赋予它的值为正。
电离能 (IE) 将1摩尔气态碱金属原子转化为气态阳离子。
$$\mathrm{M(g)\xrightarrow{IE}M^+(g)}$$
这也是一个吸热过程,其值为正。
通过释放称为电子亲和能 (EA) 的能量,将1摩尔气态卤素原子转化为气态阴离子。
$$\mathrm{X(g)\xrightarrow{-EA}X^-(g)}$$
因此,这是一个放热反应,其值计算为负数。
1摩尔气态金属离子(阳离子和阴离子)结合形成1摩尔金属卤化物晶体,在此过程中释放大量能量,称为晶格能 (U)。
$$\mathrm{M^+(g)+X^-(g)\xrightarrow{-U}MX(S)}$$
根据赫斯定律,碱金属卤化物的形成焓被认为是所有过程的总和。
$$\mathrm{\Delta H_f\:=\:\Delta H_{sub}+\frac{1}{2}\Delta H_{diss}+IE-EA-U}$$
因此,可以使用其他能量项的值来确定离子晶体的晶格能。
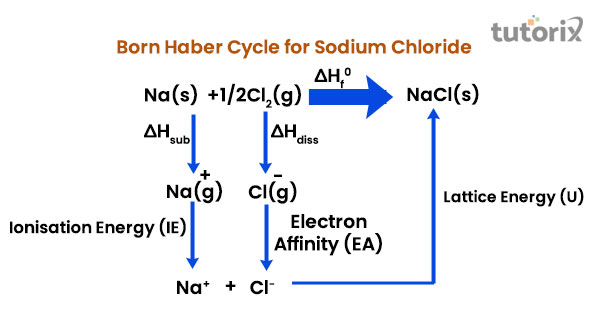
图:氯化钠的玻恩-哈伯循环
晶格能值的应用
在本节中,我们将看到晶格能值被用来描述离子固体晶体的特性。
离子固体在各种溶剂中的溶解度
离子固体的溶解度取决于两个因素:
晶格能,它紧密地结合着离子固体的组成离子;
溶剂化能,当离子固体解离时,离子与溶剂相互作用形成溶剂化离子,这是释放的能量。当水用作溶剂时,会生成水合离子,在这种情况下,溶剂化能被称为水合能。
晶格能的量级越大,离子固体越不可能解离成组成离子,但溶剂化能的量级越大,离子越有可能被溶剂化。这表明上述两种力是相反的。
因此,如果溶剂化能的量级大于晶格能,则固体将溶解在溶剂中;否则,固体不溶于溶剂。
离子固体的稳定性
晶格能的量级决定了离子固体的稳定性。例如,与 $\mathrm{CaCl \:(720\:kJ\:mol^{-1})}$ 相比,$\mathrm{CaCl_2\: (2200\:kJ\:mol^{-1})}$ 更稳定。
结论
在玻恩-哈伯循环中,电离能(即所需的能量)和晶格能(即释放的能量)贡献最大;它们的符号总是相反的,即它们相互竞争。
如果电离能超过晶格能,这意味着化合物的整体生成是一个吸热过程,则所得化合物将不稳定,因此不太可能存在。
常见问题
Q1. 何时观察到玻恩-哈伯循环计算出的晶格能值存在差异?
答:当出现以下情况时,玻恩-哈伯循环的观测值和计算值之间存在差异:
(i) 阴离子较大——由于“极化”,例如 $\mathrm{I^-}$
(ii) 阳离子较小且电荷较高,例如 $\mathrm{Be^{+2}, Mg^{+2}, or Al^{+3}}$,由于“部分共价特性”,晶格能值会发生偏差。
Q2. 晶格能如何影响金属卤化物的熔点?
答:晶格能越高,分离离子所需的能量就越高,因此离子固体的熔点就越高。
金属卤化物的熔点遵循以下顺序:
$$\mathrm{LiF\:\gt\:LiCl \:\gt\:LiBr\:\gt\:LiI}$$
$$\mathrm{LiCl\:\gt\:NaCl \:\gt\: KCl\:\gt\: RbCl\:\gt\:CsCl}$$
Q3. 离子固体溶于水的标准是什么?
只有那些水合能高于晶格能的离子固体才能溶于水。
Q4. 解释赫斯定律。
答:根据赫斯定律,当反应物转化为产物时,无论反应是单步进行还是多步进行,焓变都是相同的。赫斯定律用于在玻恩-哈伯循环中计算晶格焓。
Q5. 定义晶格能。
答:晶格能 (U) 可以定义为将1摩尔处于标准状态的晶体固体解离成构成它的气态离子所需的焓变。


 数据结构
数据结构 网络
网络 关系数据库管理系统 (RDBMS)
关系数据库管理系统 (RDBMS) 操作系统
操作系统 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C语言编程
C语言编程 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP