络合滴定法
引言
滴定法或滴定分析是一种分析方法,用于检测未知分析物的浓度。它是一种体积测量方法,因此也称为容量分析法。配制标准试剂或滴定液的溶液,然后使其与分析物反应以获得其浓度。试剂或滴定液反应的体积称为滴定体积。有各种滴定方法。络合滴定法是其中一种。它是一种滴定方法,其中有色配位配合物的形成指示了络合滴定的终点。由于它涉及金属螯合物的形成,因此也称为螯合滴定法。
什么是络合滴定法?
络合滴定法是一种容量分析方法,其终点涉及有色配合物的形成。它尤其用于检测溶液中的金属离子。为此,金属离子或阳离子与络合试剂反应。这些试剂通常是阴离子或中性分子。因此,它们与阳离子或金属离子共享其上存在的未成对电子。络合指示剂用于通过形成有色配合物来检测终点。例如,金属银与氰化物反应形成配合物,如下所示:
$$\mathrm{Ag^{+}\:+\:2CN^{-}\:\longleftrightarrow\:[Ag(CN)_{2}]^{-}}$$
中心金属原子称为路易斯酸,而配体称为路易斯碱。中心金属原子或受体与供体或配体之间形成的键是配位键。滴定中常用的滴定剂是 EDTA。它是一种六齿配体,因为它可以提供六个电子对。EDTA 的全称是乙二胺四乙酸。因此,它包含两个胺基和四个羧基。EDTA 的结构为:
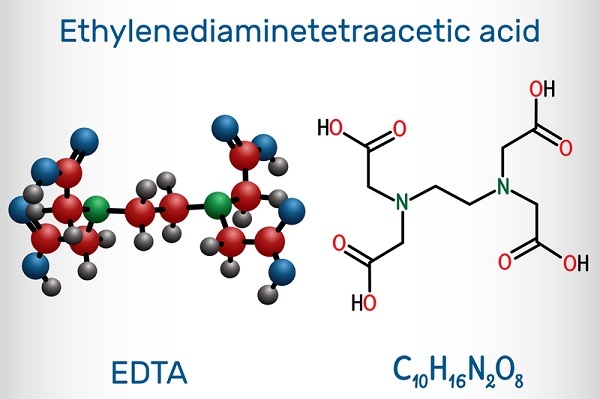
它简称为𝐻₄𝑌。它几乎可以与所有金属离子形成配合物,并且形成的配合物也足够稳定。几乎所有形成的络合离子的化学计量,无论金属离子如何,都是 1:1。除𝐶𝑟³⁺离子外,所有反应都很快,并形成无色、水溶性的化合物。金属离子与 EDTA 之间的普遍反应如下所示。
$$\mathrm{M^{n+}\:+\:H_{4}Y\:\longleftrightarrow\:MY^{(4-n)-}\:+\:4H^{+}}$$
为了获得终点,使用检测器。
络合指示剂
终点检测是络合滴定中的一个重要步骤。因为这是我们可以确定分析物未知浓度的步骤。主要有两种检测方法:目视法或金属指示剂或金属显色指示剂和仪器法。
目视法
目视法是一种常用的方法,其准确性高,成本低廉,是一种传统方法。络合指示剂中的金属离子指示剂用于检测络合滴定中的终点。有机染料通常用于此目的,因为它们可以在滴定反应过程中为金属离子着色。其中,滴定剂 EDTA 取代指示剂,与金属离子形成稳定的配合物,并且在终点处可见颜色变化。反应结束时产生的新颜色是由于指示剂中存在游离配体。使用的指示剂的一个例子是铬黑 T。该指示剂也是一种弱酸。金属离子 Mg²⁺与指示剂发生反应,如下所示:
$$\mathrm{Mg^{2+}\:+\:Hlnd^{2-}(蓝色)\:\rightarrow\:Mglnd^{-}(红色)+\:H^{+}}$$
$$\mathrm{Mglnd^{-}(红色)\:+\:H_{2}Y^{2-}\rightarrow\:Mgy^{2-}(无色)\:+\:Hlnd^{2-}(蓝色)\:+\:H^{+}}$$
颜色从红色变为蓝色是终点。

仪器法
仪器法涉及借助电位滴定法测量金属配合物的氧化还原电位。铂电极可用于此目的。另一种可用的指示剂是汞指示剂,其中在金属和 Hg-EDTA 配合物反应期间测量电位变化。反应为:
$$\mathrm{Mg^{2+}\:+\:Hg\:-\:EDTA^{2-}\:\rightarrow\:Hg^{2+}\:+\:Mg\:-\:EDTA^{2-}}$$
另一种方法是光度滴定法,其中测量吸光度。在吸光度光谱中形成的配合物的值为零,这是使用这种方法的基础。
使用 EDTA 的络合滴定法
使用 EDTA 的滴定剂在络合滴定法中很常见。由于 EDTA 的络合物形成足够稳定,并且使用金属显色指示剂进行终点检测也经济且准确。例如,使用 EDTA 来测定水中金属离子以检测水的硬度。水中存在的离子与金属形成络合物,如下所示:
$$\mathrm{M^{+2}\:+\:H_{2}Y^{2-}\:\rightarrow\:MY^{2-}\:+\:2H^{+}}$$
$$\mathrm{M^{+3}\:+\:H_{2}Y^{2-}\:\rightarrow\:MY^{-\:}+\:2H^{+}}$$
使用的指示剂是铬黑 T。当铬黑 T 不含金属离子时,其颜色会从酒红色变为蓝色。这样就可以检测到终点。

络合滴定法的类型
下面讨论不同类型的络合滴定法。
直接滴定 - 与酸碱滴定一样,阳离子或金属离子直接用 EDTA 滴定。并使用指示剂检测终点。
返滴定 - 在这种滴定中,存在 EDTA 的返滴定。当分析物与 EDTA 之间的反应几乎完成时,这种类型的滴定法包括添加更多量的 EDTA 并再次进行滴定。这些适用于不能与 EDTA 形成足够稳定化合物的滴定。
置换滴定 - 当直接滴定和返滴定无效时,使用这种方法。它包括用等量的金属离子置换 EDTA 配合物中的镁或锌离子。然后用 EDTA 溶液再次滴定释放出的离子。使用的指示剂是铬黑 T。它通常用于测定钙盐。
间接滴定 - 用于可以与阳离子形成沉淀的阴离子使用这种滴定法进行估计。它们不能与 EDTA 反应,因此使用间接滴定法分析它们。通常使用这种方法估算钡离子。
络合滴定法的应用
它用于估计水的硬度。
它用于解释尿液样本。
它用于估计药物中的金属浓度。
它可用于估计溶液中弱酸的含量。
结论
滴定法对于估算溶液中存在的分析物的未知浓度非常重要。络合滴定法在其中很重要。可以使用这种技术估算金属离子。在此过程中常用的滴定剂是 EDTA。使用的指示剂是有机染料。铬黑 T 是常用的指示剂。还存在一些其他指示剂,并且具有不同的滴定类型。络合滴定法主要有四种类型。它们是直接滴定、间接滴定、返滴定和置换滴定。由于基于该技术的估计在经济上是良性和高效的,因此该技术的应用也很广泛。
常见问题解答
1. 谁发现了络合滴定法?
格罗德·施瓦岑巴赫在发现目视颜色指示剂的过程中发现了络合滴定法。
2. 络合滴定法中是否使用缓冲液?
为了抵抗反应过程中 pH 值的变化,使用缓冲液。并且该滴定法中涉及的所有反应都依赖于 pH 值。因此,在此滴定过程中添加缓冲液非常重要。
3. 螯合剂如何在络合滴定法中使用?
可以与金属形成螯合物的有机试剂是螯合剂。这些化合物含有两个或多个可以与金属离子形成配合物的基团,从而形成螯合物。并且是一种称为螯合滴定的络合滴定法。
4. 络合滴定法的局限性是什么?
局限性是:
进行分析需要大量的物质。
在此过程中人为错误的可能性很高。
会产生大量的化学废物作为副产物。
5. 什么是掩蔽和解蔽?
在分析过程中通过与化学成分反应而干扰的试剂是掩蔽剂。解蔽是一个过程,其中掩蔽的物质恢复其参与化学反应的能力。锰、氰化物等是掩蔽剂的例子。三乙醇胺是一种解蔽剂。


 数据结构
数据结构 网络
网络 关系数据库管理系统 (RDBMS)
关系数据库管理系统 (RDBMS) 操作系统
操作系统 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C语言编程
C语言编程 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP