现代元素周期表中的元素电负性
介绍
永斯·雅各布·贝采利乌斯于1811年提出了“电负性”一词。电负性是指在形成化学键时,特定化学元素的原子吸引共用电子对的倾向。其符号为X。电负性可用于定量估计键能、键的化学极性方向和强度以及其他键的性质。
在共价键中,如果结合原子的电负性差异很大,则电负性较高的原子不太可能完全控制电子对,从而形成两个离子。在这种情况下,电负性较高的原子形成阴离子,而电负性较低的原子形成阳离子。电负性受核电荷、原子壳层中额外电子的数量和位置等因素影响。在周期表中,电负性从左到右增加,从上到下减小。
什么是电负性?
电负性是指原子在共价键中吸引共用电子的能力。元素的电负性越高,它吸引共用电子的能力就越强。电负性最高的元素是那些在带正电的原子核和价电子之间具有最少核心分子轨道,并且需要最少电子来完成其价壳层的元素。两种结合原子之间的电负性差异将决定形成的键的类型。如果电负性差异较大,则形成离子键;如果电负性差异较小,则形成共价键。

由于电负性差异引起的极性键。
电负性的周期性趋势
一般来说,电负性沿周期表从左到右增加,从上到下减小。因此,铯的电负性最低,而氟的电负性最高。过渡金属和内过渡金属之间的规律性不是很好。这个一般规律也有一些例外。由于d区收缩,锗和镓的电负性分别高于铝和硅。
由于3d电子对较高的核电荷的屏蔽作用不强,过渡金属第一排的第四周期元素原子半径较小。较小的原子尺寸与较高的电负性相关。
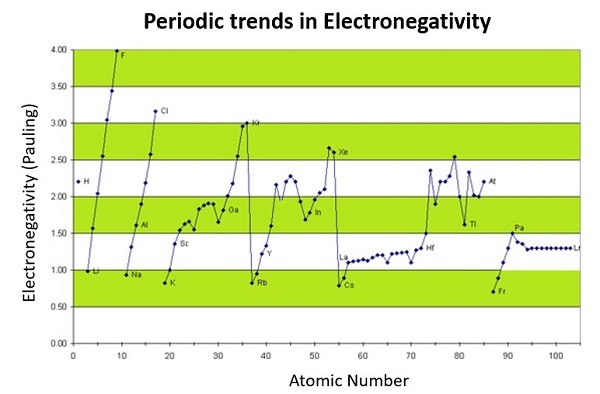
电负性表
电负性的数值范围为0到4,这决定了最终分子是极性的还是非极性的。例如,钠和氯形成离子键,其中氯夺取一个电子,形成钠阳离子(Na+)和氯阴离子(Cl-)。钠的电负性值为0.93,而氯的电负性值为3.16。下表列出了第一、二、三周期的元素及其电负性值。
惰性气体通常不包含在元素周期表的任何趋势中,因为每种惰性气体都具有完整的八电子组或完整的价电子层。
| 原子序数 | 元素名称 | 符号 | 电负性值 |
|---|---|---|---|
| 1 | 氢 | H | 2.2 |
| 3 | 锂 | Li | 0.98 |
| 4 | 铍 | Be | 1.57 |
| 5 | 硼 | B | 2.04 |
| 6 | 碳 | C | 2.55 |
| 7 | 氮 | N | 3.04 |
| 8 | 氧 | O | 3.44 |
| 9 | 氟 | F | 3.98 |
| 11 | 钠 | Na | 0.93 |
| 12 | 镁 | Mg | 1.31 |
| 13 | 铝 | Al | 1.61 |
| 14 | 硅 | Si | 1.9 |
| 15 | 磷 | P | 2.19 |
| 16 | 硫 | S | 2.58 |
| 17 | 氯 | Cl | 3.16 |
| 19 | 钾 | K | 0.82 |
| 20 | 钙 | Ca | 1 |
| 21 | 钪 | Sc | 1.36 |
| 22 | 钛 | Ti | 1.54 |
| 23 | 钒 | V | 1.63 |
| 24 | 铬 | Cr | 1.66 |
| 25 | 锰 | Mn | 1.55 |
| 26 | 铁 | Fe | 1.83 |
| 27 | 钴 | Co | 1.88 |
| 28 | 镍 | Ni | 1.91 |
| 29 | 铜 | Cu | 1.9 |
| 30 | 锌 | Zn | 1.65 |
| 31 | 镓 | Ga | 1.81 |
| 32 | 锗 | Ge | 2.01 |
| 33 | 砷 | As | 2.18 |
| 34 | 硒 | Se | 2.55 |
| 35 | 溴 | Br | 2.96 |
影响电负性的因素
以下是一些影响元素电负性的因素:
原子的氧化态
随着氧化态的增加,原子的电负性也增加。例如,Fe+3的电负性高于Fe+2。
原子的尺寸
如果原子尺寸小,则该原子的电负性值较高。相反,尺寸大的原子将具有较低的电负性值。
原子的杂化
杂化态也影响原子的电负性。具有较强s特性的杂化会产生较高的电负性。
| 杂化态 | s特性 | 电负性 |
|---|---|---|
| sp | 50% | 3.29 |
| sp2 | 33.33% | 2.75 |
| sp3 | 25% | 2.48 |
有效核电荷
随着有效核电荷的增加,原子更有可能吸引共享电子,从而增加电负性。
连接到原子的取代基的影响
与CH3I相比,CF3I中的C原子获得更大的正电荷。因此,CF3I中的C原子比CH3I中的C原子电负性高得多。取代基引起原子电负性的变化会改变原子的化学行为。
结论
电负性是指原子在共价化学键中吸引共享电子的能力。电负性在周期表中从左到右增加,从上到下减小。两种结合原子之间的电负性差异将决定形成的键的类型。
常见问题
1. 电负性差异多大才算极性?
通常,电负性差异至少为0.5才能将键分类为极性共价键。
2. 电负性差异多大才算离子键?
如果两个结合原子之间的电负性差异大于2.1,则该键被认为是离子键。
3. 哪个元素的电负性值最高?
氟的电负性值最高,即3.98,所有其他电负性测量值都是相对值。
4. 哪一族元素电负性最高?
卤素的电负性最高,而碱金属的电负性最低。
5. 酸的强度如何根据电负性而变化?
在元素周期表中,酸性强度沿周期从左到右增加,而沿族从上到下减弱。这是因为沿族向下原子尺寸增大(增加电子层),而沿周期向右原子尺寸减小(减少电子层)。


 数据结构
数据结构 网络
网络 关系数据库管理系统 (RDBMS)
关系数据库管理系统 (RDBMS) 操作系统
操作系统 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C语言编程
C语言编程 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP