电子
简介
自然界中所有物质的基本组成部分是原子。而原子是由称为亚原子粒子的微小成分组成的。它们是原子的基本组成部分。质子、中子和电子是三种亚原子粒子。原子核是拥有原子总质量的部分。
原子核由两种亚原子粒子组成:中子和质子。因此,亚原子粒子电子是无质量的粒子。科学家提出的许多实验和理论导致了这些亚原子粒子的发现。几年前,人们认为原子是物质不可分割的组成部分。1897年,物理学家 J.J. 汤姆逊通过实验发现了电子。他进行的电子发现实验是阴极射线管实验。
电子简介
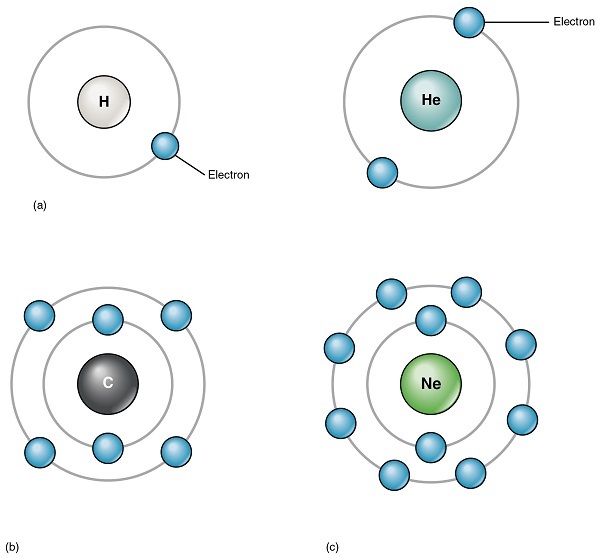
在原子中,中子和质子被包裹在一个称为原子核的空间中,原子核被电子云包围。原子中存在的电子决定了每种元素及其化合物的化学和物理性质。电子围绕原子核在称为电子层或轨道的虚线路径上运动。电子围绕原子核的排列方式是,能量较低的电子排列在原子核附近,而能量较高的电子排列在离原子核较远的距离。因此,高能电子存在于原子的外表面。这些电子也称为价电子。电子所在的电子层为 𝐾、𝐿、𝑀、𝑁 等。并且每个电子层只能容纳特定数量的电子。电子层容纳的电子数量在不同的元素中并不相同。除此之外,还有亚层。它们是 𝑠、𝑝、𝑑 和 𝑓。它们也拥有可以容纳的特定数量的电子。电子按照能级顺序排列。如果一个原子不包含很多电子,它可能有一些空的电子层和亚层。一些元素中电子的流动方式为,
汤姆逊阴极射线实验
J.J. 汤姆逊早在 19 世纪末就开始在阴极射线管中进行实验。阴极射线管是完全抽空的玻璃材料。它是一个在两端包含两个电极的管子。当在这个管子上施加高电压时,就会发生粒子流。虚构的粒子流起源于阴极端。这就是为什么它被称为阴极射线。产生的射线是不可见的,因此借助于另一侧带有磷光材料的涂料来检测。射线被检测到,但当时并没有定义其特性。为了了解其特性,J.J. 汤姆逊在阴极表面周围放置了两个带相反电荷的极板。
人们观察到,当射线照射到负电极板上时会发生偏转,并被吸引到正电极板上。因此,他得出结论,从硬纸板材料中产生的粒子带负电,因为同种电荷相互排斥。然后他还计算了粒子的荷质比,但很明显,它远小于原子的质量。他还通过改变金属作为电极进行了实验,并且始终重复相同的特性和观察结果。因此,J.J 汤姆逊在进行此实验后得出结论。并且是
从阴极产生的粒子是带负电的粒子。
它只是原子的一部分,因为它没有质量。发现其质量是氢原子质量的 $\mathrm{\frac{1}{2000}}$。
这些粒子存在于所有元素中。
在其他科学家的认可后,阴极射线被命名为电子。该实验导致了亚原子粒子电子的发现,并且消除了道尔顿提出的原子是不可分割的粒子的理论。因此,在此实验之后还提到了原子的一种新模型。

定义电子
电子是原子中存在的带负电的亚原子粒子。它们是稳定的粒子。电子的电荷为 1.60 × 10−19𝐶。与原子的质量相比,电子的质量非常小。电子的质量为 9.11 × 10−31𝐾𝑔。电子以等于光速的一部分的速度运动。金属导电的原因是这些电子的存在。1891 年,科学家斯通尼将电子这个名称赋予了带负电的粒子。电子不包含任何其他成分。电子的特性在不同的元素中也不同。这种亚原子粒子的特性总是独一无二的。
电子的性质
下面列出了电子的某些性质。
| 电子 | e- |
|---|---|
| 电荷 | 负电,$\mathrm{1.60\times\:10^{-19}\:C}$ |
| 质量 | $\mathrm{9.11\times\:10^{-31}\:Kg}$ |
| 位置 | 存在于原子核外。 |
| 稳定性 | 稳定 |
| 吸引力 | 朝向带正电的粒子。 |
电子和化合物
元素中价电子的存在是形成多种化合物的根本原因。在元素中,其最外层电子层存在特定数量的电子。自然界中的每种元素都旨在通过维持其最外层电子层的八隅体来获得稳定性。元素之间共享电子对会导致共价键的形成,从而形成化合物。例如,氧原子中最外层的电子为 6 个,它需要两个电子才能达到稳定的构型。因此,当两个氧原子共享电子对时,就会形成化合物或分子 𝑂2。因此,电子以这种方式有助于化合物的形成。
结论
电子是原子中重要的组成部分之一。它们是原子中存在的带负电的无质量粒子。它围绕原子核在称为电子层或轨道的虚线路径上旋转。这些电子层和亚层也有子类别。它们只能携带特定数量的电子。电子是由科学家 JJ 汤姆逊在他的阴极射线管实验中发现的。他的发现得到了许多科学家的认可,并证明它是一种无质量的粒子。所有元素最外层电子层中电子的存在是形成化合物的根本原因。因为化合物是通过共享电子形成的。
常见问题
1. 请说明 J.J. 汤姆逊的原子枣糕模型?
在发现电子后,得出结论认为原子几乎是中性的,因此它们必须包含一定量的带正电的粒子或质子。他提出了一种原子模型,其中电子嵌入在正电荷球体中。它就像枣糕布丁,因此被称为枣糕模型。但它不是正确的原子模型。
2. 谁建立了正确的原子模型?
卢瑟福进行的 α 粒子散射实验对原子模型做出了合理的解释。通过他的实验,证明了原子中存在的电子围绕原子核旋转,并且原子中有一个小空间,所有质量都集中在那里。即使它也有一些局限性,但这仍然是公认的原子模型。
3. 谁发现了中子?
1932 年,科学家查德威克发现了原子中带中性电荷的亚原子粒子。
4. 谁发现了质子?
1900 年,科学家欧内斯特·卢瑟福发现了质子。并且是通过他的金箔实验发现的。
5. 什么是电子理论?
根据电子理论,自然界中存在的所有物质都由分子组成,自然界中存在的每个分子都由原子组成,每个原子都由质子、中子和电子等粒子组成。


 数据结构
数据结构 网络
网络 关系型数据库管理系统
关系型数据库管理系统 操作系统
操作系统 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C 语言编程
C 语言编程 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP