能级
简介
约翰·道尔顿认为,原子是物质中包含的最小的微观粒子。约翰·道尔顿没有研究固体中的微观粒子。相反,他主要研究气体粒子。尽管 J.J. 汤姆孙解释了原子的中性性质,但他无法解释原子中原子核的概念。1909 年,欧内斯特·卢瑟福提出了新的核能理论。
欧内斯特·卢瑟福,一位英国物理学家,参与了使用α粒子的放射性探针对原子的研究。卢瑟福的原子模型由尼尔斯·玻尔修改。尼尔斯·玻尔修改了原子的稳定性和氢原子的线光谱,这是由卢瑟福解释的。他是第一个提供原子体系的充分概念解释以解释氢原子线光谱的人。
什么是能级?
原子的能级或轨道或壳层被定义为恒定的圆形路径,原子中的电子在这些路径上围绕原子核运动。如果你取一个原子,电子围绕原子核旋转。但是,电子不能选择它们围绕自身的轨道。这些电子被一些特定的能量所环绕。每个轨道都包含不同的能级。电子在几个壳层或稳定的能级上围绕原子核运行。电子在从一个能级跳到另一个能级时会发射能量或吸收能量。这种能量表现为光子。
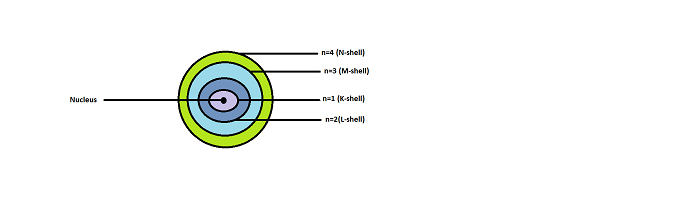
图 1. 原子的能级
量子数
原子中每个电子的身份都基于它的四个量子数。量子数就像门牌号。
例如,如果我们标记任何位置,我们首先写下国家、省份、城市,最后我们会提到门牌号。类似地,我们可以表示原子中电子的位置。表示原子轨道和电子在原子内部排列和分布的数字称为量子数。
玻尔原子模型
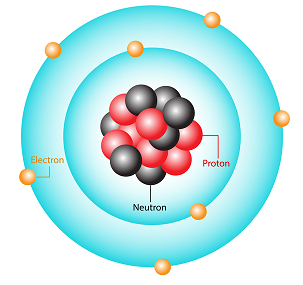
电子由于库仑静电吸引而绕原子核运行。用于保持电子在轨道上运动的向心力由这种库仑力提供。原子中的电子分散在原子核周围的不同路径上;电子在沿着这些路径移动时不会辐射电磁能量。因此,允许的各个轨道是稳定的。在这种稳定轨道中电子的角动量是量子化的。这意味着它的值是$\mathrm{\frac{h}{2\pi}}$的整数倍。它可以写成$\mathrm{l=nħ}$。这里 ħ 是普朗克常数$\mathrm{\frac{h}{2\pi}}$的简写形式,n 是量子数。此条件是量子化条件。电子和一些粒子具有双重性质。并且电子轨道的周长必须是德布罗意波长的整数倍。
$$\mathrm{2\pi r=n\lambda }$$
这里 n=1,2,3,......
从德布罗意波长方程$\mathrm{\lambda =\frac{h}{mv}}$ 这里 'h' 是普朗克常数。
$$\mathrm{\therefore\:2\pi r=n(\frac{h}{mv})}$$
$$\mathrm{mv r=n(\frac{h}{2\pi})}$$
当任何质量为 m 和速度为 υ 的粒子以半径为 r 的圆周运动时,其角动量的数值为
$$\mathrm{l=r(mv)}$$
$$\mathrm{mvr=l=n ħ}$$
轨道的能量不是恒定的,而是具有单独的值。这些单独的值称为能量的量子化。当电子吸收或发射光子时,它会跳到另一个轨道。在此过程中,会产生能量。此能量等于两个轨道之间的能量。
$$\mathrm{\Delta E=E_{final}-E_{initial}=h v=h\frac{c}{\lambda}}$$
c- 光速;$\mathrm{\lambda}$ - 辐射的波长;ν - 辐射的频率。原子的能量变化决定了发射辐射的频率。轨道运动的频率不影响能量变化。
玻尔对能级的解释
原子的能级或轨道或壳层被定义为恒定的圆形路径,原子中的电子在这些路径上围绕原子核运动。
电子在其轨道上不会获得或损失能量。每个轨道都有一个固定的能级,玻尔称它们为能态或能级。
当电子移动到更高或更低的能级时,它将吸收或发射能量。
1、2、3、4 是赋予产生能量的轨道的名称。它们也分别称为 K、L、M 和 N 壳层。这些数字称为主量子数 (n)。
最靠近原子核的 K 壳层 (n=1) 能量最低。较高的能级分别命名为 L、M 和 N。随着距原子核距离的增加,轨道的能量也随之增加。
每个能级 (n) 最多可以容纳的电子数为$\mathrm{2n^{2}}$。当电子从较低能级跃迁到较高能级时,会吸收能量。当电子从较高能级跃迁到较低能级时,会释放能量。
结论
原子的能级或轨道或壳层被定义为恒定的圆形路径,原子中的电子在这些路径上围绕原子核运动。表示原子轨道和电子在原子内部排列和分布的数字称为量子数。每个轨道都包含不同的能级。轨道的能量不是恒定的,而是具有单独的值。轨道的单独值称为能量的量子化。电子在其轨道上不会获得或损失能量。每个轨道都有一个固定的能级,玻尔称它们为能态或能级。
常见问题
Q1. 氢原子和氘原子有什么区别?
答:氢原子和氘原子的区别在于,氢原子没有中子,但它包含电子和质子,而氘原子包含一个质子、一个中子和一个电子。
Q2. 什么是氘原子?
答:H.C. 乌雷和他的团队于 1931 年发现,即使是(主要的)微弱的谱线也会伴随着氢光谱线在较短波长处出现。由于同位素位移效应(或同位素漂移),相同元素的同位素会发射略微不同的光谱线。这些微弱谱线的出现证实了氢原子中存在同位素。这被称为氘。
Q3. 什么是化合价?
答:元素的化合价是该元素与另一种元素结合的能力程度。它等于参与化学反应的电子数。具有 1、2、3、4 等价电子的元素的化合价为 1、2、3、4。如果元素的价电子为 5、6、7,则其化合价为 3、2、1。这意味着分别需要 3、2、1 个电子才能获得实现原子稳定所需的 8 个电子。如果原子的外壳充满电子,则原子的化合价为零。
Q4. 解释卢瑟福的原子理论
答:原子的大部分是空的。原子核是原子中心高度带正电的区域。与原子核相比,原子的尺寸非常大。电子围绕原子核运行的圆形路径称为轨道。原子通常是中性的。即原子中的质子和电子数相等。卢瑟福的原子结构对应于太阳系。
Q5. 什么是玻尔-贝里规则?
答:电子围绕原子核在称为轨道的圆形路径上运动。电子共享以填充每个轨道称为电子共享。原子中这些轨道中电子的共享填充在一定条件下进行。这些定律称为玻尔和贝里的电子结构规则。


 数据结构
数据结构 网络
网络 关系数据库管理系统
关系数据库管理系统 操作系统
操作系统 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C 编程
C 编程 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP