氟
引言
氟是一种相对较新的元素。古代少量使用含氟矿物。16世纪早期科学家格奥尔格·阿格里科拉最初在冶炼的背景下讨论了萤石(氟的来源矿物)的经济应用。“萤石”(随后是“氟”)是阿格里科拉创造的术语。18世纪后期发现了氢氟酸。19世纪初,人们意识到氟与氯一样,是化合物中的一种键合元素。人们发现萤石是氟化钙。由于氟与其他元素结合紧密以及氟化氢的毒性,分离氟的尝试一直没有成功。
亨利·莫瓦桑,一位最终获得诺贝尔奖的法国化学家,于1886年电解了氟化钾和氢氟酸的溶液,从而制得了元素氟。氟首次大规模生产和使用是在二战期间的曼哈顿计划中。杜邦公司在本世纪初开发了主要的含氟化学品,包括聚四氟乙烯(特氟龙)塑料和制冷剂(氟利昂)。
什么是氟?
卤素气体氟是元素周期表第17族元素。该元素的原子序数为9。氟最显著的特性是它是元素周期表中电负性最强的元素。在常温下,它呈现为剧毒的浅黄色双原子气体。氟的电负性是所有元素中最高的,在鲍林标度上为3.98。
氟的电子构型和化学性质
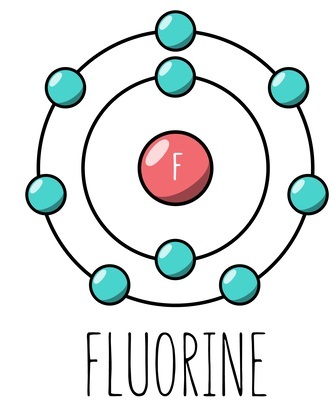
第17族气体氟的原子序数为9。氟是一种卤素,化合价为一。它缺少一个电子,是一个电子受体。这些物质因为接受电子所以是氧化剂。记住,电子供体总是还原剂,电子受体总是氧化剂。由于其高电负性,氟是卤素中最强的氧化剂。氟的电子结构为$\mathrm{1s^{2}2s^{2}2p^{5}}$。我们可以从该元素的电子结构看出它缺少一个电子。因为它是一个亲电体,所以它会接受一个电子。
氟的性质
氟表现出不同的物理和化学性质。
氟的化学性质
氟是一种强电负性元素,是最强的氧化剂之一。根据鲍林标度,氟的电负性为3.98。
由于其尺寸小,原子核与电子之间的强吸引力导致需要非常高的能量才能提取电子。氟的第一电离能为1680.6 𝐾𝐽/𝑀𝑜𝑙。因此,从一摩尔氟中去除一个电子需要1680.6 𝐾𝐽的能量。
氟的标准电极电位为2.87 𝑉。与所有其他因素相比,这是最高的。
氟只有一个稳定的同位素,即氟19。
氟的物理性质
氟是所有卤素中最轻的,估计原子质量为19个粒子。
在自然状态下,氟以气体的形式存在。它是一种浅黄色的轻气体。
氟的沸点为-188°C,熔点为-219.6°C。
氟的原子半径
氟是一种非常小的元素,其原子半径极小。因此,氟原子具有非常强的核力。氟是卤素原子中最小的,原子半径仅为147 pm。
氟的原子质量是多少?
最轻的卤素气体氟的质量仅为19 amu;具体来说,是18.99 amu。按照惯例,我们将其四舍五入并计为19。
关于氟的趣闻
在地壳中,氟是第13位最丰富的元素。
氟是一种非常活泼的元素,从未以其纯净形式被发现过。它总是与另一种元素结合存在。
氟可以使水以明亮的火焰燃烧。
除了空气外,氟也存在于地壳中。煤和其他元素中含有痕量的氟。
氟在空气中几乎不存在。大约十亿分之五十。在第二次世界大战之前,氟在工业中并不为人所知。
直到那时,氟才被商业化生产。每个人都只知道氟是一种可以结合形成盐的元素。然而,在二战期间,六氟化铀被发现具有核能力并成为能源来源。从那时起,氟的工业化生产速度呈指数级增长。
动物需要氟离子,这有助于增强它们的牙齿和骨骼。在某些地方,它被添加到饮用水中。当饮用水中氟化物的浓度低于百万分之二时,人们认为可以避免龋齿。然而,高于此浓度,可能会导致儿童牙齿珐琅质出现斑点。牙膏也含有氟化物。人体内平均含有3毫克氟化物。过量的氟化物是有害的。氟是一种剧毒元素。
结论
氟是元素周期表中卤素家族的成员之一。在室温下,氟以具有难闻气味的黄色气体形式存在。吸入这种气体有害。氟冷却后会变成黄色液体。氟-19是该物质唯一稳定的同位素。氟的主要来源是萤石。
常见问题
1. 氟的用途是什么?
氟的用途包括:
在气体扩散过程中,该元素还用于制造六氟化铀,该过程将铀-235与铀-238分离以用于反应堆燃料。
商业生产氢氟酸和三氟化硼是因为它们作为催化剂对生产各种化学分子的烷基化过程有用。
为了降低儿童龋齿的发生率,通常将氟化钠添加到饮用水中。
制药和农业行业最近一直在大量使用含氟化合物。选择性氟取代会显著改变这些化学物质的生物学特性。
2. 氟的起源是什么?
1529年,被称为“矿物学之父”的格奥尔格·阿格里科拉最初报道了主要的矿物来源萤石,而“氟”这个词就源于这个拉丁词根。据他介绍,萤石是一种被称为助熔剂的添加剂,在冶炼过程中有助于熔化矿石和炉渣。
3. 为什么氟如此重要?
我们骨骼保持坚固的能力取决于氟。如果我们每天使用含氟牙膏两次,它还可以预防龋齿。除了导致骨质疏松症和龋齿外,过量吸收氟还会影响肾脏、骨骼、神经和肌肉。
4. 氟是如何在自然界中发现的?
由于其反应性强,氟气,也被称为化学界的“母夜叉”,长期以来被认为不存在于自然界中。现在,慕尼黑的科学家们有证据证明这种气体天然存在,被困在一种被称为暗紫萤石的石头——暗紫萤石中。
5. 为什么氟的反应性如此强?
氟由于其电负性而具有极强的反应性。原子的电负性是指其吸引共用电子对的倾向。简单地说,如果氟和氯进行拔河比赛,氟总是会获胜,因为它具有更强的电负性。


 数据结构
数据结构 网络
网络 关系型数据库管理系统 (RDBMS)
关系型数据库管理系统 (RDBMS) 操作系统
操作系统 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C语言编程
C语言编程 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP