格氏试剂
简介
格氏试剂是一种由法国科学家维克多·格林尼亚发明的有机金属试剂。它的符号为 RMgX。其中 R 代表烷基,即含有碳的分子,使其成为有机部分,而 Mg 代表镁,是一种金属。在图示中,X 代表卤素。因此,它被称为烷基卤化镁。
Mg 和 X 之间的键是离子键,而有机金属键是共价键。乙基溴化镁和苯基溴化镁是格氏试剂的两个例子。
格氏试剂具有极强的反应活性。这是因为镁的电子对转移到 R 位置,使之部分带负电,而镁部分带正电。因此,键中形成了极性。在反应中,R 和镁之间的键断裂,由于负电荷的存在,-R 变得更具反应性。由于它在化学键中将电子对转移到亲电试剂,格氏试剂也被称为强亲核试剂。
格氏试剂是一种有机镁化合物,化学式为 RMgX,其中 R 代表芳基或烷基,X 代表卤素。它们通常通过使镁与烷基卤化物或芳基卤化物反应制备。法国科学家维克多·格林尼亚发现了格氏试剂。
什么是格氏试剂?
格氏试剂是一种非常有效的化学试剂,在有机化学中占据着重要的地位。通过使该试剂与酮和醛反应,可以生成醇。格氏试剂可以用卤代烷烃和芳基卤化物制备。存在镁与碳的极性键。
格氏试剂反应机理
当具有 sp2 或 sp3 杂化的碳原子的芳基卤化物或卤代烷烃与镁反应时,会形成格氏试剂,这是一种有机金属试剂。格氏试剂写成 RMgX,其中 R 是芳基或烷基,X 是卤素。
反应过程的第一步是芳基或烷基卤化物与镁的反应。
该过程将亲电的烷基卤化物转化为亲核的碳负离子基团。反应中的试剂靶向羰基中极性键中的亲电碳。
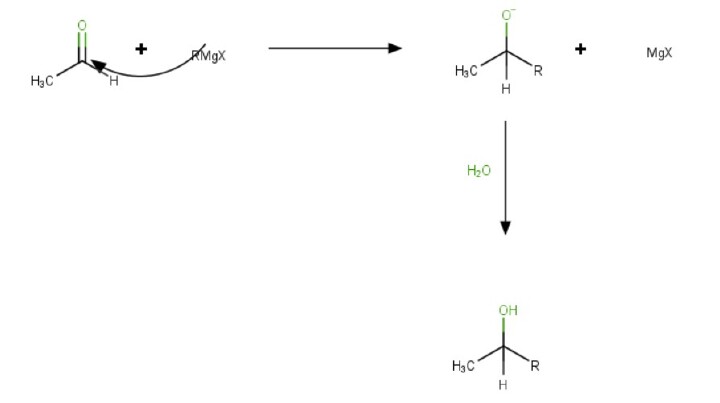
溶剂在反应过程中起着重要作用。当格氏试剂引入羰基后形成醇时,反应完成。
由于卤素的反应活性按 F<Cl<Br<I 的顺序降低,因此不使用有机氟化物来制备格氏试剂。碳-镁极性键与醛、酮和酯的碳迅速反应。
格氏试剂与醛和酮的反应机理是由于碳-镁键的极化,而这种极化是由镁和碳的电负性引起的。
写出格氏试剂的一般化学式。
格氏试剂,任何用通用公式 RMgX 表示的镁 (Mg) 衍生物,其中 R 是烃:X 是卤素,最常见的是氯或碘。
如何制备格氏试剂?
格氏试剂可以通过烷基卤化物与芳基卤化物反应制备。
在以无水乙醚为溶剂的情况下,使烷基卤化物和 Mg 反应时,必须注意溶剂必须是干燥的,因为格氏试剂在水中或存在水分的情况下反应性非常强。
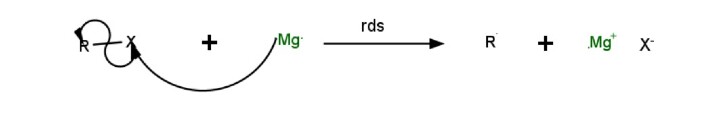
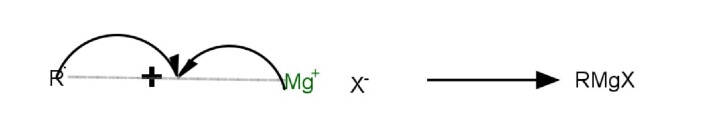
格氏试剂的制备
四氢呋喃也可以用作该反应合成的替代溶剂。反应中的碳负离子是由试剂的卤化镁部分以及格氏试剂形成的。需要注意的是,当大规模进行时,格氏试剂的反应可能是放热的。
由格氏试剂制备醇
格氏反应是制备仲醇、伯醇和叔醇的最简单方法。格氏试剂与甲醛反应生成伯醇。
$$\mathrm{CH_3 MgBr+HCHO→CH_3 CH_2 OH+Mg(Br)Cl}$$
任何其他醛与格氏试剂反应都会生成仲醇。
$$\mathrm{CH_3 MgBr+CH_3 CHO→(CH_3 )_2 CHOH+Mg(Br)Cl}$$
此外,当格氏试剂与酮反应时,会生成叔醇。
$$\mathrm{CH_3 MgBr+CH_3 COCH_3→(CH_3 )_3 C(OH)+Mg(Br)Cl}$$
格氏试剂与醇反应机理
该机理始于 MgX 与羰基氧之间形成酸碱加合物。格氏试剂 MgBr 充当路易斯酸,接受来自羰基氧的一对孤对电子。这使得氧带正电荷,从而增加了羰基碳上的部分正电荷,使其更容易受到亲核攻击。
路易斯酸碱加合物生成
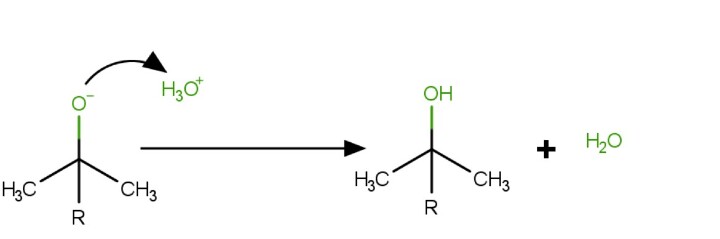
亲核试剂的进攻
来自格氏试剂的碳负离子亲核试剂与酸碱配合物中的亲电 C 原子反应,生成 C-C 键。CO 的 2 个电子被推入羰基的氧原子,形成四面体中间体镁醇盐。
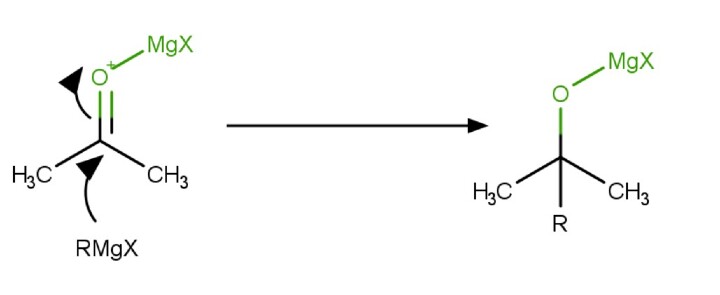
质子化
加入酸性水溶液将中间体醇盐转化为醇。
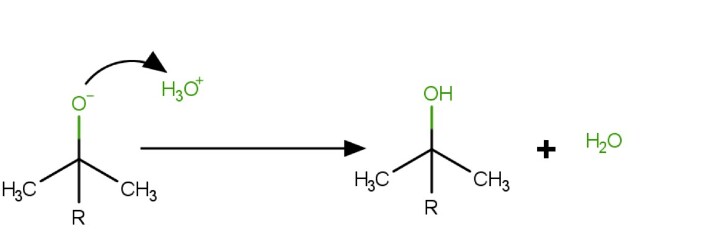
结论
格氏试剂 (RMgX) 常用于有机合成。然而,这些高度反应性化学物质需要使用易燃溶剂,这使得它们的运输变得复杂。大环主体柱芳烃可以捕获和稳定具有直链烷基的格氏试剂,同时保持其反应活性。格氏试剂的制备是烷基溴化物与镁金属反应生成有机镁试剂的过程。
常见问题
1. 格氏试剂的缺点是什么?
格氏试剂的主要缺点如下:-
它们与质子溶剂(如水)或含有酸性质子的官能团(如醇和胺)迅速反应。这会导致产物发生变化和质子解,以及氧化反应。
格氏试剂的产物也会受到大气水分的影响。因此,在操作过程中确保没有水分存在非常重要。可以使用超声波来活化镁金属,然后镁金属可以吸收反应气氛中的水。
2. 格氏试剂有什么作用?
格氏反应之所以重要,是因为它们可以导致碳-碳键的形成。格氏试剂是有机合成中非常有用的工具,因为它们是强碱,并且会与质子分子反应。
3. 格氏反应是什么类型的反应?
格氏反应是一种有机金属化学反应,其中酮或醛的羰基被烯丙基、烷基或芳基-Mg 卤化物(格氏试剂)引入。该过程依赖于碳-碳键的形成。
4. 镁在格氏试剂中起什么作用?
用于制备中的镁金属表面顶部的氧化物涂层会阻止它与烷基溴化物反应。
5. 什么导致了格氏试剂的亲核性?
当考虑碳的电负性分别为 2.5 和镁为 1.1 时,碳-镁键偏向碳。例如,碳比镁具有更多的电子,因此是亲核的。


 数据结构
数据结构 网络
网络 RDBMS
RDBMS 操作系统
操作系统 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C 语言编程
C 语言编程 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP