预测方向反应
简介
预测方向反应是一个预测化学反应选择方向的概率的过程,这样做是为了一个非常重要的原因。该化学反应发生的位置决定了作为反应最终结果产生的材料的有效特性。专家可以通过进行一系列数学反应来预测结果。
化学反应
化学反应的过程被称为一种产生某种反应物的方法。这是挥发性和非挥发性元素混合在一起的过程。在这个特定的混合物中,所有必要的因素,如温度和密度都会发生变化,以改变特定反应的速度。变化要么会大规模发生,要么会以非常微小的方式发生。这就是为什么在将所有这些元素和因素置于反应过程下后,它们将产生具有显著特性的最终结果的原因。因此,这就是化学反应的全部含义,它们具有各种相关的属性。
反应商和平衡常数
特定反应的商将保持在其常数点。每个人都有可能通过了解商上的总压力来计算商。同样,不同类型的反应物具有大量的重量,这些重量构成产物的整个分子质量。这与计算平衡常数的方式相同。唯一的区别在于,通过平衡计算得到的常数涉及产物的总分子量。在这里,考虑了分压和分子浓度,而不是元素的分子量。
计算平衡常数
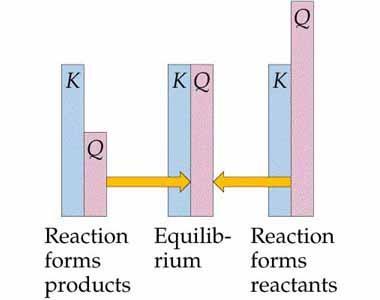
图 1 - 反应平衡和商的表示
计算平衡常数的过程是通过使用常数产物来进行的。这就是为什么当反应处于其常数状态时,它们必须注意产物的平衡常数。所有这一切都能够发生,当反应的平衡总是发现处于一个非常稳定的位置。所有这一切都能够发生,当反应过程将其根植于特定位置时。这是确定分子总浓度用于计算平衡常数的过程的位置。
计算反应
计算反应的过程是为了得到反应发生的速率。有各种类型的方法用于计算此反应的过程。此反应的整个过程以反应发生的变化形式出现,这在化学品的帮助下发生。此计算的结果是通过除以可能发生的更改而得到的。此反应的被除数成为所有反应物在此反应过程中所花费的总时间。
计算反应商
当以这种反应形式陈述的点测量产物的化学浓度时,就会发生反应商。这些化学反应的数量发生在它们倾向于避免不在反应过程中的化学反应的时间。当所有这些分子的总浓度非常高时,此反应过程肯定会出现。
预测化学反应的方向
$\mathrm{Q_{c}\:>\:K_{c}}$,在这种情况下,反应通过向反应物达到平衡的方向移动而发生。
$\mathrm{Q_{c}\:<\:K_{c}}$,这是反应过程开始向产物达到平衡的一侧滚动的时间。Qc = Kc,这是一种不试图向前或向后移动的反应。这意味着反应过程处于平衡点。
这些是在化学反应过程中发现的三种预测。
结论
本教程重点介绍了定义反应传递方式的反应。这就是为什么有一些部分解释了化学反应的含义。因此,当预测环节得出结论时,某些化合物的生产商能够决定化合物的有效性。
常见问题
1. 化学反应中的左右预测是什么意思?
当某个化学反应过程发生时,反应物要么会将反应剂添加到方程式中。当在平衡状态下添加此试剂时,反应将向右侧移动,即向产物侧移动。另一方面,添加产物会使平衡向左移动。
2. KC 如何帮助预测化学反应的方向?
当 Qc > Kc 时,Qc 将下降以保持平衡。它们将根据 Kc 进行,这将确保反应的方向。
3. 化学反应如何说明它是可逆的?
化学反应的方向通过对所有情况都朝着不同的方向移动来说明它是可逆的。在可逆化学反应的情况下,它可以向任一方向发生。


 数据结构
数据结构 网络
网络 关系型数据库管理系统
关系型数据库管理系统 操作系统
操作系统 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C 编程
C 编程 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP