原子核的大小
引言
在物理学领域,识别基本结构对于研究原子核至关重要。然而,如果没有卢瑟福进行金箔实验来理解原子的结构,原子核的结构就不会为世人所知。值得注意的是,早些时候,原子的结构被认为是汤姆逊提出的“梅子布丁模型”。在这个模型中,人们认为布丁带有正电荷物质,而梅子代表负电荷的分布。
原子核的定义
在卢瑟福用氦原子进行金箔实验后,人们得出结论:原子核是一个相对较小、密度较大的区域,包含质子和中子 (Khetselius *et al*. 2018)。
质子和中子位于原子的中心。然而,在发现之后,人们构建了几个模型,详细地表明原子核由中子和质子组成,并被被称为电子的带负电粒子的云包围。
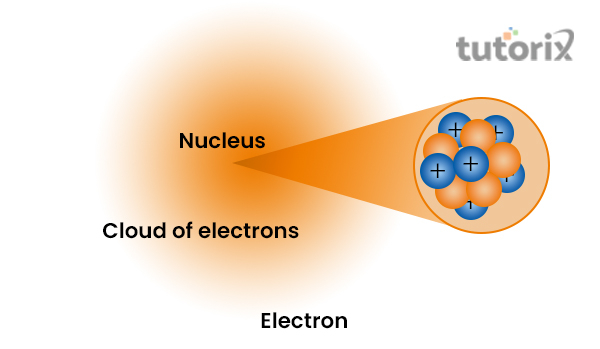
图1:原子核的结构
与原子核相关的历史
通常被称为原子核的原子核一词来源于拉丁语单词“nucleus”,并与另一个单词“nux”相关,意思是坚果或核。然而,这个词是由迈克尔·法拉第提出的,用于描述原子的中心。J.J.汤姆逊在阴极射线管实验的支持下发现原子包含带负电的粒子 (Vigen, 2018)。
汤姆逊的梅子布丁模型指出原子同时具有带正电和带负电的粒子。最终,卢瑟福的发现确立了原子的真实结构。
原子核的特征
人们注意到几个特征,例如,在原子核中,带正电的粒子——质子,质子的数量决定了特定元素的原子概念。中子的数量决定了原子所具有的同位素类型 (Geeksforgeeks.org, 2022)。
质子和中子的重量都比微小的电子粒子大。因此,这表明原子核的质量集中在原子核周围 (Schoolscience.co.uk, 2022)。
此外,人们注意到原子核内的质子和中子之间存在强大的电力。由于原子核周围存在正电荷,电子粒子会被吸引到原子核。
卢瑟福的金箔实验
卢瑟福想要展示电子在原子内的排列,这导致他进行了金箔实验,该实验展示了α粒子(ɑ)的快速运动特性。使用带双电荷的氦离子来表示α粒子,使用金箔是因为它可以制成薄而细的薄层 (Spark.iop.org, 2022)。
然而,ɑ粒子的质量大于质子,因为他认为只会发生轻微的偏转。
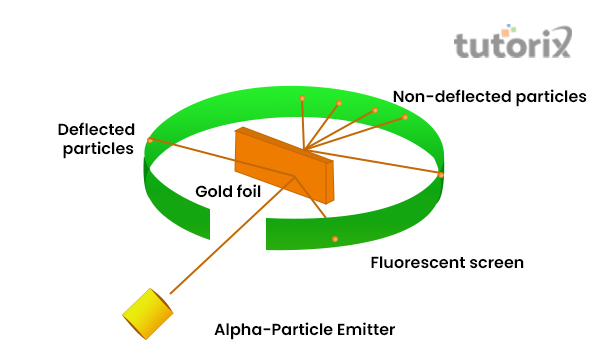
图2:卢瑟福的金箔实验
卢瑟福的观察和结论
通过他的观察,人们注意到大多数α粒子直接穿过而没有发生任何偏转,而一些α粒子以一定角度发生偏转。此外,人们还注意到一些α粒子反弹 (Chem.libretexts.org, 2022)。
由此可以得出结论:原子的中心包含正电荷,原子的质量集中在原子的中间区域。电子存在于它们围绕原子核的特定轨道中。此外,人们注意到原子核的大小比原子的大小相对较小。
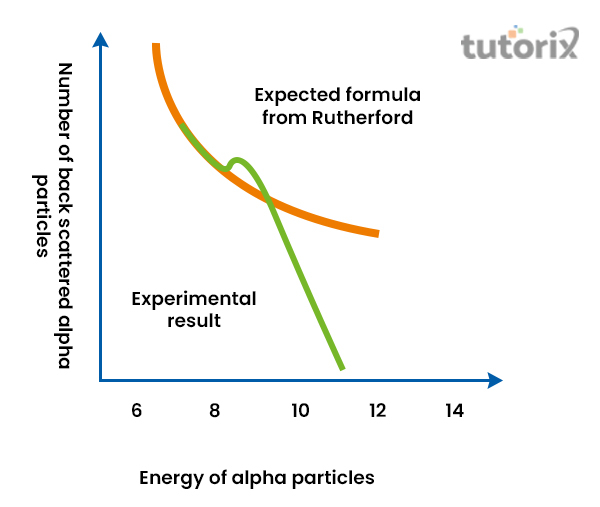
图3:卢瑟福公式和偏差
原子核的大小和密度
从卢瑟福的金箔实验中,人们注意到原子核的大小比原子的尺寸相对较小。例如,氢原子的尺寸比原子核的尺寸大145,000倍。由于存在单个原子,原子核的尺寸为1.75 * 10-15 m (Spark.iop.org, 2022)。然而,用于测量原子核尺寸的公式可以表示为:𝑅 = 𝑅0𝐴1/3,其中,𝑅0 = 1.2 * 10-15 m。
结论
在本教程的总结性思考中,我们理解到原子的结构对于定义原子核的大小很重要。从卢瑟福的金箔实验中,人们注意到原子具有特定的结构,其中原子核位于中间,电子在其周围的特定轨道上旋转。对于许多原子,人们注意到原子核的大小相对小于原子的尺寸。
常见问题
Q1. 卢瑟福实验中使用金箔的原因是什么?
A1:卢瑟福在实验中使用金箔是因为金箔比用作卢瑟福射线散射实验一部分的其他材料具有更高的延展性。然而,使用了相对较薄的箔片,因此它们有助于形成非常薄的薄膜。
Q2. 卢瑟福实验中α粒子偏转的原因是什么?
A2:根据实验,卢瑟福认为α粒子将直接穿过箔片。然而,实验表明,α粒子在穿过箔片时路径会发生轻微偏转。其原因是由于粒子内部存在的电荷彼此排斥。
Q3. 我们从卢瑟福的金箔实验中学到了什么?
A3:我们从卢瑟福的金箔实验中了解到与原子相关的几个重要事实。从这个实验中,我们知道原子只是空的空间,中心有一个相对较小的原子核,并带正电荷。


 数据结构
数据结构 网络
网络 关系型数据库管理系统 (RDBMS)
关系型数据库管理系统 (RDBMS) 操作系统
操作系统 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C语言编程
C语言编程 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP