三氧化硫
简介
“三氧化硫”也用“$\mathrm{SO_{3}}$”表示,它主要是一种化学化合物,并存在多种形式的修饰。在其化学形式中,主要以分子或晶体的形式存在。作为液体,它无色,并在空气中蒸发,但仅在特定条件下。它主要以其强大的氧化能力和高反应活性而闻名。根据热力学,它是不稳定的,因为它可能引发火灾。
什么是“三氧化硫”?
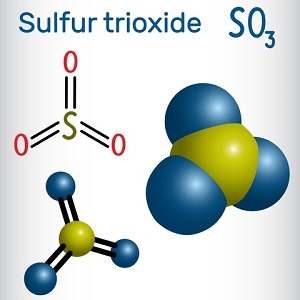
图 1 - 三氧化硫的结构
“三氧化硫”或“$\mathrm{SO_{3}}$”主要因其与“硫酸”的相似性而被大量生产。“三氧化硫”主要以三种形式存在——首先是气态单体,其次是晶态三聚体,第三是固态聚合物。“三氧化硫”在低于正常室温的温度下以固态形式存在。在其气态形式中,“三氧化硫”甚至会导致“酸雨”。“三氧化硫”充当“磺化反应”或负责生产“磺酸”的反应的试剂。
“三氧化硫”的性质
“三氧化硫”的不同物理和化学性质如下:
物理性质
液态时,它实际上没有气味和颜色。
它的密度为“1.92 g/cm³”,并且易溶于水,因此是可溶的。
它在大约“44.9 °C”时沸腾,在大约“16.9 °C”时熔化。“摩尔质量”为 80.066 g/mol。
化合物中存在的“共价键合单元”为 1,“氢键受体”的数量为 3。此外,化合物的复杂度大约为“61.8”。
化学性质
“三氧化硫”反应速度快,并且由于其强大的氧化性能,也充当“氧化剂”。
与水反应时,“三氧化硫”会生成“硫酸”。反应如下所示
与碱“氢氧化钠 (NaOH)”反应时,“三氧化硫”会生成“硫酸氢钠 $\mathrm{(NaOHSO_{4})}$”。这是一种常用的工业化学品?反应如下所示
$$\mathrm{SO_{3}\:+\:H_{2}O\:\rightarrow\:H_{2}SO_{4}}$$
$$\mathrm{SO_{3}\:+\:NaOH\:\rightarrow\:NaHSO_{4}}$$
$\mathrm{SO_{3}}$的“分子键合”和“结构键合”
如几何模型所示,“$\mathrm{SO_{3}}$”的对称性为“D3h”。根据“VSEPR”理论,当处于气态时,它呈现“平面三角形”结构。这意味着一个原子占据中心位置,3 个原子占据角位置,如同“等边三角形”。
在其气态形式中,“三氧化硫”的“电偶极矩”为零。这是因为“S-O”键以“120°角”存在。
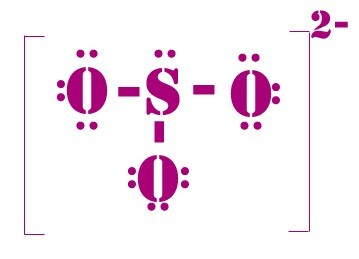
图 2 - “$\mathrm{SO_{3}}$”的刘易斯结构
创意共享署名-相同方式共享 3.0,公共领域,经由维基共享资源
“硫”原子呈现“+6”的“氧化”态,其“形式电荷”为零,具体取决于“电子计数形式”。
根据“$\mathrm{SO_{3}}$”的“刘易斯结构”,存在一个“S=O 双键”和一对“S–O 配位键”,不考虑“d 轨道”。
制备
“三氧化硫”在不同的条件下,通过不同的方法制备。它们如下:
大气条件
“三氧化硫”由空气中的“二氧化硫”产生,因为它直接氧化,反应据推测如下进行:
$$\mathrm{SO_{2}\:+\:\frac{1}{2}O_{2}\:=\:SO_{3}\:\Delta\:H\:=\:-198.4}$$
实验室条件
在实验室中,“三氧化硫”是通过合成制备的,涉及“硫酸氢钠”及其经过两步“热解”的过程。“焦硫酸钠”作为“中间产物”提供。该过程涉及大约“315 °C”的“脱水”,并按如下方式进行:
$$\mathrm{2NaHSO_{4}\:\rightarrow\:Na_{2}S_{2}O_{7}\:+\:H_{2}O}$$
另一方面,还有一系列反应在约“460 °C”下发生,如下所示
$$\mathrm{Na_{2}S_{2}O_{7}\:\rightarrow\:Na_{2}SO_{4}\:+\:H_{2}O}$$
工业条件
“$\mathrm{SO_{3}}$”的生产通常通过工业环境中的“接触法”完成。一种特定的“硫化铁”矿石“黄铁矿”被燃烧以生产“三氧化硫”。在经过“静电沉降”过程后,“$\mathrm{SO_{2}}$”在催化剂存在下在大约“400 至 600 °C”的温度下被氧化。
“三氧化硫”的应用
“三氧化硫”是“磺化”反应的快速试剂。通常用于制造染色产品、药物和洗涤剂?“三氧化硫”也用于生产“硫酸”。
“$\mathrm{SO_{3}}$”也具有漂白性能,这有助于去除“过氧化氢”的残留物。它还可以利用其消化特性去除“木质素”的浆液。
它在制造“光电电池”和利用“太阳能”的设备中很有用。
注意事项
除了具有强大的氧化性能外,“三氧化硫”由于其高度腐蚀性,会导致摄入和吸入时造成严重的灼伤。因此,在处理“三氧化硫”时需要格外小心和谨慎,因为它还会产生具有高度腐蚀性的“硫酸”。
结论
“三氧化硫”或“$\mathrm{SO_{3}}$”是一种化学性质的化合物,具有强大的氧化和反应活性。它在液态时基本上无味且无色,密度为“1.92 g/cm³”,并且具有良好的溶解性。它主要在大气、实验室和工业环境中,使用不同的方法制备。由于它作为试剂参与“磺化反应”,因此它被用于生产染料、不同的药物产品和洗涤剂。
常见问题
1. “三氧化硫”和 H2O 如何反应?
两者主要反应生成“硫酸”,该过程需要大量热量。该反应主要在燃烧“金属硫化物”时进行,然后在催化剂下转化“SO3”,然后再与水反应。
2. “三氧化硫”在大气条件下是如何制备的?
“三氧化硫”是在空气中的“二氧化硫”中获得的,因为它容易氧化,反应据推测如下进行:
$\mathrm{"SO_{2}\:+\:\frac{1}{2}O_{2}\:=\:SO_{3}\:\Delta\:H\:=\:-198.4"}$
3. 评论“三氧化硫”的有害性质?
不小心摄入和吸入“三氧化硫”可能会因其高度腐蚀性而导致体内发生灾难性灼伤。


 数据结构
数据结构 网络
网络 关系型数据库管理系统
关系型数据库管理系统 操作系统
操作系统 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C 语言编程
C 语言编程 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP