硼
简介
第 13 族(III A 族)的元素包括硼 (B)、铝 (Al)、镓 (Ga)、铟 (In) 和铊 (Tl)。由于存在三个价电子,这些元素也被称为类金属和三价金属。硼的外层电子构型可以写成 $\mathrm{1s^2\:2s^2\:2p^1}$。在接下来的章节中,我们将讨论硼的出现、物理和化学性质。
硼的发现和提取
硼是一种相对不常见的元素,约占地壳的百万分之九 (ppm)。戴维最初于 1807 年通过将硼酸与钾熔化而分离出该元素。它主要以硼砂 $\mathrm{(Na_2B_4O_7.10H_2O)}$ 和硼酸 $\mathrm{(H_3BO_3)}$ 的浓缩矿床形式存在,并且不存在于游离状态。硼镁石 $\mathrm{(2Mg_3B_3O_{15}.MgCl_{2})}$、硬硼钙石 $\mathrm{(Ca_2B_6O_{11}.5H_2O)}$、硼钠钙石 $\mathrm{(Ca_2B_4O_7.NaBO_2.8H_2O)}$ 和曲晶硼砂 $\mathrm{(Na_2B_4O_7.4H_2O)}$ 是一些其他值得注意的矿物。
硼的物理性质
电离能
由于 p 电子比 s 电子结合得松散,因此 III A 族元素的第一电离能低于 II A 族元素。硼的前三个电离能的值如表所示。与第一电离能相比,第二和第三电离能更高。正如预期的那样,硼具有最大的电离能值。
| 元素 | $\mathrm{IE_1}$ | $\mathrm{IE_2}$ | $\mathrm{IE_3}$ | $\mathrm{IE_1 + IE_2 + 1E_3}$ |
|---|---|---|---|---|
| 硼 | 801 | 2427 | 3659 | 6887 |
氧化态
硼在其所有化合物中的氧化态为 (+III)。其他元素的氧化态为 (+I)。(+III) 态的稳定性随着向下移动而降低,而 (+I) 态的稳定性则提高。
化合物的性质
由于其小的离子尺寸和高的电离能,硼形成高度共价的化合物。由于同样的原因,硼是一种典型的非金属。
结构、熔点和沸点
硼具有有趣的二十面体结构,其中 $\mathrm{B_{12}}$ 作为基本单元。除镓外,其他元素都具有紧密堆积的金属结构。因此,B 的熔点和沸点相当高。
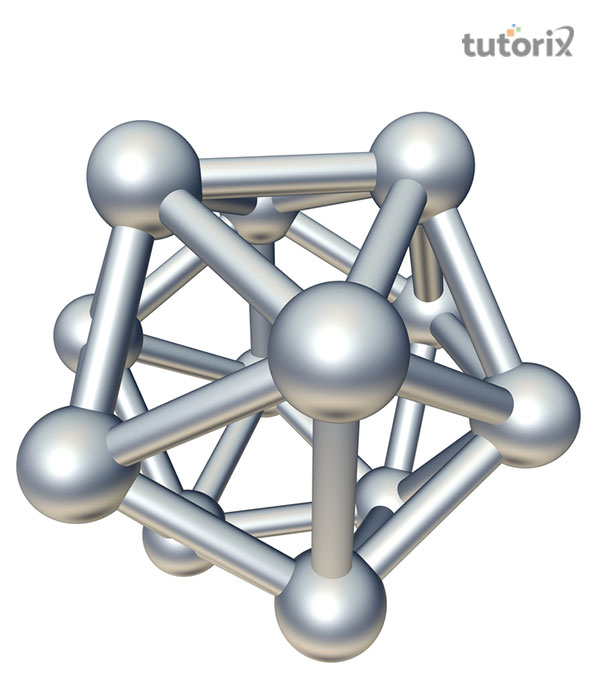
图 1:二十面体 B12 单元
硼和硅之间的对角线关系
同素异形体:这些元素都存在无定形和结晶形式。
存在:这两种元素在自然界中仅以化合物的形式存在。它们不会自由存在。
金属特性:由于它们的电离能高,这两种元素都是非金属和绝缘体。
密度和熔点:这些元素的特征是密度低和熔点高。
化合物的性质:由于它们的电离能高,它们形成共价配合物。
氧化物和含氧酸:这两种元素都在空气中燃烧生成氧化物,氧化物微溶但熔点高。氧化物非常稳定,并且只有轻微的酸性。当氧化物溶解在水中时,会产生弱酸。
$$\mathrm{H_3BO_3 + 2H_2O\:\rightarrow\:H_3O^+ + [B(OH)_4]^–}$$
$$\mathrm{H_4SiO_4 + 2H_2O\:\rightarrow\:H_3O^+ + [Si(OH)_5]^–}$$
硼的化学性质
与空气和水的反应
硼在其纯结晶状态下反应性很低,但在其细分散的无定形状态下反应性很高。当在空气中加热时,它会产生 $\mathrm{B_2O_3}$,在极高温度下会生成 BN。它不与 $\mathrm{H_2O}$ 反应。
$$\mathrm{4B+3O_2\:\rightarrow\:2B_2O_3}$$
$$\mathrm{2B + N_2\:\rightarrow\:2BN}$$
与酸和碱的反应
无定形硼会还原热的浓硫酸和硝酸。
$$\mathrm{B + 3HNO_3\:\rightarrow\:H_3BO_3 + 3NO}$$
$$\mathrm{2B + 3H_2SO_4 \:\rightarrow\:2H_3BO_3 + 3SO_2}$$
硼从熔融的苛性碱中释放出 $\mathrm{H_2}$,导致形成硼酸盐
$$\mathrm{2B + 6NaOH\:\rightarrow\:2Na_3BO_3 + 3H_2}$$
与氨的反应
除硼外,所有金属都与 $\mathrm{NH_3}$ 反应生成酰胺,硼在极高温度下与 $\mathrm{NH_3}$ 反应生成氮化物。
$$\mathrm{2B + 2NH_3\:\rightarrow\:2BN + 3H_2}$$
硼的用途
硼用于生产高强度钢。
硼用作银焊和铜焊中的助熔剂。它还用于制造洗涤剂和玻璃纤维。
硼硅酸盐玻璃由硼的氧化物制成。
硼是一种高效的还原剂
$$\mathrm{3CO_2 + B\:\rightarrow\:2B_2O_2 + 3C}$$
$$\mathrm{3\:SiO_2 + 4B\:\rightarrow\:2B_2O_3+ 3Si}$$
结论
1808 年,法国科学家约瑟夫·路易·盖-吕萨克和路易·雅克·泰纳尔通过加热氧化硼 $\mathrm{(B_2O_3)}$ 和钾金属发现了硼,英国化学家汉弗莱·戴维也独立发现了硼。
硼是元素周期表中 III A 族的一员。纯结晶硼是黑色、有光泽的半导体,在高温下像金属一样导电,但在低温下则表现为近乎绝缘体。
常见问题
Q1. 说明硼和硅之间的相似之处。
答:硼和硅之间的相似之处如下
(i) 这两种元素在自然界中仅以化合物的形式存在。它们不会自由存在。
(ii) 这些元素都存在无定形和结晶形式
(iii) 由于它们的电离能高,这两种元素都是非金属和绝缘体。
Q2. 硼如何与碱反应?
答:硼通过从熔融的苛性碱中释放氢来生成硼酸盐。
$$\mathrm{2B + 6NaOH\:\rightarrow\:2Na_3BO_3 + 3H_2}$$
Q3. 说明一种制备硼的方法。
答:将三氧化二硼在高温下用 Na、K 或 Mg 粉末还原。用强盐酸煮沸硼以溶解氧化镁后,会生成无定形状态的深棕色硼。
$$\mathrm{B_2O_3 + 6K\:\rightarrow\:2B + 3K_2O}$$
$$\mathrm{B_2O_3 + 3Mg\:\rightarrow\:2B + 3MgO}$$
Q4. 硼的物理性质是什么?
答:硼的物理性质如下
(i) 硼是一种非金属元素,熔点为 2453 摄氏度,但在 1873 摄氏度时会挥发。
(ii) 其比重为 2.34,无定形状态下为棕色。
(iii) 其结晶形式非常耐用且耐热,比重为 3.3。
Q5. III A 族元素的一般外层电子构型是什么?
答:III A 族元素的一般外层电子构型为 $\mathrm{ns^2\:np^1}$。


 数据结构
数据结构 网络
网络 关系型数据库管理系统
关系型数据库管理系统 操作系统
操作系统 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C 语言编程
C 语言编程 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP