固体的特性
简介
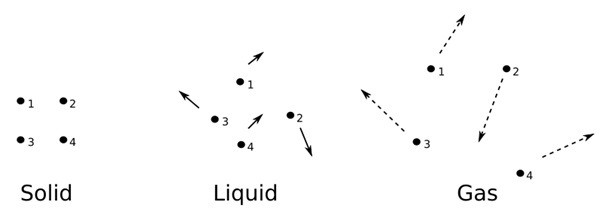
固体是紧密堆积的结构,不容易受外部因素的影响。
它们具有确定的体积、质量和形状。然而,固体不会流动。固体的化学和物理性质在固态化学和固态物理学中进行研究。
自然界有四种不同的物质状态。根据它们的分子间相互作用以及组成粒子的性质,它们被分类为固体、气体、液体和等离子体。
Solid-liquid-gas.jpg: Sadi Carnot衍生作品: Dave.Dunford (talk) 13:43, 15 December 2010 (UTC), Solid-liquid-gas,标记为公共领域,维基共享资源上有更多详细信息
什么是固态?
固体是三种物质形态之一,具有紧密堆积的结构以及确定的体积和形状。
化学键将分子结合在一起,这是坚硬结构的原因,因为分子牢固地结合在一起,它们的动能小于气体和液体。
此特性使它们能够抵抗外部因素的作用,因此保持恒定的体积和形状,这与易挥发的气体和液体相反。
固体的特性
由于显著的分子间相互作用将物质的组成粒子结合在一起,因此固体具有特定的重量、体积和形状。在低温下,分子间力趋于控制热能,固体保持稳定状态。对于给定的物质,液体和固态的体积和质量相同。
导电性、密度和光学透射只是固体的众多特性中的一部分。
常见的食盐、水冰、干冰、岩石、大多数金属和木材都是固体的例子。当固体被加热时,原子或分子会获得动能。
固体有两种类型:晶体和非晶体。最常见的固体形式是晶体固体。它们的特征是原子以一致的晶体排列,赋予其长程有序性。非晶体或无定形物质则缺乏这种长程有序性。晶体固体是指原子、离子或分子以规则、明确的模式排列的固体。
分子固体、离子固体、共价固体和金属固体是四种主要的固体类型。离子固体由带正电和负电的离子组成,这些离子通过静电相互作用结合在一起;键合强度以晶格能表示。离子固体具有高熔点且非常坚硬。
某些化学物质会形成晶体固体,其粒子以高度有序的方式排列;而另一些则形成非晶固体,其内部结构无序。
固体的机械性能解释了诸如变形和抗力之类的特性。塑性、磨蚀性、延展性、展性以及韧性都是机械性能的例子。
固体的特点是其结构刚度和抗力,能够抵抗施加在其表面的力。与液体不同,固体物质不会移动以适应容器的形状,也不会像气体一样膨胀以充满所有可用空间。
固体具有确定的形状和尺寸,并且不可压缩。
晶体材料中的离子、原子或分子以有序且对称的方式排列,这种排列在整个晶体中重复出现。晶胞代表固体中最小的重复结构,类似于墙上的砖块。晶格是由晶胞组成的网络。
用途
固态材料广泛应用于我们周围的各个地方。其中最重要的包括:
移动电话和个人电脑是电子设备的例子。
激光器和光纤是光学设备的例子。
因此,整个现代发明概念都基于固态物理学的概念。
应用
诸如建筑物中的电线和窗玻璃,以及冰箱中的磁铁等常见物品都严重依赖于固态。
逻辑和存储位由固态硅制成。
结论
可以得出结论,固体是四种物质状态之一,具有紧密堆积的结构。固体的特点是其体积和形状。固体不可压缩,因此不会流动。强烈的分子间相互作用将组成粒子结合在固体中。根据组成粒子的排列方式,固体分为晶体/非晶体两类。晶体固体具有规则的几何形状、各向异性的熔点和锋利的边缘。它们具有明确的熔化热和解理特性。非晶态材料是无序的伪液体或过冷液体。它们没有解理特性,并且是各向同性的。它们在较宽的温度范围内软化,并且在加热时可能会结晶。
常见问题
Q1. 为什么糖比空气和水更坚硬?
A1. 糖是一种晶体固体,其组成分子在三维空间中紧密堆积。
在这个三维区域中,它们通过强大的分子间力紧密结合在一起,这些力在长距离内以可预测的模式作用。这限制了这些分子的移动性,使它们只能在其平均位置附近振动。另一方面,在液体和气体中,分子由中等和弱的分子间力结合在一起。因此,它们具有动能并且可以移动。因此,它们不如糖坚硬。
Q2. 玻璃是一种固体。为什么它被称为过冷液体?
A2. 玻璃是非晶固体,因为它们缺乏明确的形状,并且由通过相对较弱的力结合在一起的分子组成。虽然它们具有规则的重复模式,但这些模式只能在有限的距离内观察到。因此,粒子的结构变得极其无序。由于组成粒子的无序排列,它们被称为伪固体或过冷液体。
Q3. 为什么石墨比金刚石更能导电?
A3. 要导电,化合物必须包含自由电子或离域电子。在石墨中,每个碳原子与附近的三个其他碳原子相连。这释放了第四个电子使其能够移动。另一方面,金刚石由于其由强共价键形成的四面体结构,不包含自由电子。由于这些自由电子,石墨与不含自由电子的金刚石相比,能够导电。
Q4. 塑料是各向同性材料吗?
A4. 各向同性材料的特性在不同方向上测试时不会发生变化。塑料是一种非晶固体,由于组成粒子的无序排列,其特性在不同方向上不会改变。它非常延展,可以形成任何形状。由于其组分的特性在任何方向上都是相同的,因此其行为也高度可预测。所有这些特性共同使其成为各向同性的。
Q5. 为什么石墨比金刚石更脆?
A5. 金刚石和石墨都是碳化合物。区分它们的是组成粒子键合的性质。在金刚石中,碳原子通过强共价键紧密地结合在晶格结构中。在这个四面体结构中,每个碳原子都与另外 4 个碳原子相连,并且没有自由电子。因此,金刚石更坚硬。在石墨中,碳原子的结合形成了自由电子。每个碳原子只与附近的三个其他碳原子相连。由于其特性,石墨比金刚石更脆。


 数据结构
数据结构 网络
网络 关系型数据库管理系统 (RDBMS)
关系型数据库管理系统 (RDBMS) 操作系统
操作系统 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C语言编程
C语言编程 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP