氯
介绍
氯是一种化学元素,原子序数为17。它属于元素周期表中的17族。其化学式为Cl₂,电子构型为$\mathrm{1s^{2}\:2s^{2}2p^{6}3s^{2}3p^{5}\:(or\:[Ne]^{10}3s^{2}3p^{5})}$。这种元素在工业和各种家用工作中都有多种用途。通过加压可以将其转化为液态。
什么是氯?

化学元素Cl₂是卤素元素中第二轻的成员。它属于元素周期表中的17族(VIIa族)。它是一种腐蚀性、有毒的黄绿色气体,会刺激眼睛和呼吸系统。它位于元素周期表中氟和溴之间,在室温下以气态存在。其电子构型为$\mathrm{1s^{2}2s^{2}2p^{6}3s^{2}3p^{5}\:(or\:[Ne]^{10}3s^{2}3p^{5})}$。
它是地球上海洋中第三丰富的元素。它具有强烈的气味,也存在于人体中。它由两种同位素组成,原子质量分别为35和37。有时它以有毒气体的形式存在。通过加压可以将其转化为液体并储存。吸入大量氯气会导致肺水肿。
性质
物理性质
| 颜色 | 黄绿色 |
| 状态 | 室温下为气态 |
| 气味 | 令人不适的窒息性气味 |
| 密度 | 3.214g/cm³ |
| 溶解度 | 可溶于水 |
| 沸点 | -34.04°C |
| 熔点 | -101°C |
| 原子序数 | 17 |
| 原子量 | 35.453 g·mol⁻¹ |
| 鲍林电负性 | 3.0 |
| 范德华半径 | 0.127 nm |
| 离子半径 | 0.184 (-2) nm; 0.029 nm (+6) |
| 同位素 | 4 |
| 电子层 | $\mathrm{[Ne]3s^{2}3p^{5}}$ |
| 第一电离能 | 1255.7 kj·mol⁻¹ |
| 第二电离能 | 2298 kj·mol⁻¹ |
| 第三电离能 | 3822 kj·mol⁻¹ |
| 标准电极电势 | -1.36 V |
| 发现者 | 卡尔·威廉·舍勒 (1774年) |
| 毒性 | 剧毒 |
表1——氯的物理性质
化学性质
| 化合物 | 聚氯乙烯、盐酸和氯化钠 |
| 与金属的反应性 | 干燥的氯对大多数金属都有反应性,但仅在加热时才发生反应。 |
| 燃烧 | 在潮湿环境下,与碱金属反应会发生燃烧。 |
| 爆炸性 | 某些混合物具有爆炸性。 |
| 氧化 | $\mathrm{Cl_{2}O\:,\:ClO_{2}\:,\:Cl_{2}O_{6}\:,\:Cl_{2}O_{7}\:and\:Cl_{2}O_{8}}$是氯的氧化物。 |
图2——氯的化学性质
结构
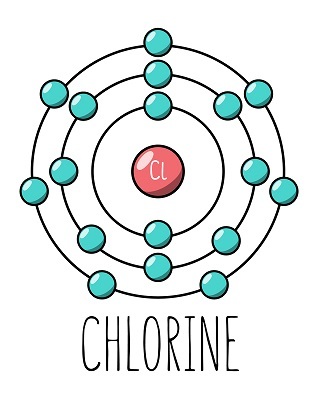
氯的原子序数为17,这意味着Cl₂在其原子结构中含有17个质子和17个电子。存在三个主要的电子壳层,电子排列在这些壳层中。第一个电子壳层包含2个电子,第二个壳层包含8个电子,第三个壳层包含7个电子。这表明氯的化合价为7。最重要的是,氯只需要一个电子就能完成其八隅体构型。这就是为什么氯的化合价也可以认为是1的原因。
用途
氯有多种用途,被认为是消毒水的主要元素。它是污水和工业废物消毒过程的一部分。在造纸和纺织品生产过程中,它用作漂白剂。Cl能够溶于水,这就是为什么它被用于家用漂白剂的原因。它也用于药品的制造过程。
它有助于降低胆固醇,控制关节炎疼痛,缓解过敏症状。氯有助于提纯沙粒中的硅,并将其转化为太阳能电池板芯片。在安全气囊、坐垫和保险杠的制造过程中,它被使用。Cl通过保护作物免受病虫害的侵害,有助于作物的丰收。它还有助于保持厨房表面无菌。氯被用于制造用于智能手机、笔记本电脑和计算机的高速处理器。
结论
本教程总结道:氯(Cl)是地球海洋中第三丰富的元素。它具有不同的特性,在家用和工业(如造纸业)中有很多用途。它呈黄绿色,气味非常强烈。氯是由两种稳定的同位素组成的混合物,例如氯-35和氯-37。Cl也以负离子的形式存在于人体中,称为氯离子。
常见问题
1. 哪些食物中含有大量的氯?
含有大量氯的食物包括西红柿、海藻、莴苣、黑麦、橄榄和芹菜。氯化钾具有常见的盐基,可用于食品加工。关于氯最重要的一点是,它也以负离子的形式存在于人体中,称为氯离子。
2. 氯是天然存在的吗?
据观察,氯在地球上并不天然存在。关于它最重要的一点是,电解海水可以产生氯。它被认为是人体中第九丰富的元素。
3. 氯有哪些用途?
氯有不同的用途,例如消毒水。它是污水和工业废物消毒过程的一部分。它在纺织品和纸张的生产过程中用作漂白剂。许多家务活都是通过漂白完成的,它在清洁产品中也有多种用途。
4. 为什么氯如此有害?
呼吸过程中过量摄入氯会导致肺部积液。这种情况被称为肺水肿,据观察,当一个人接触压缩液体时,会导致皮肤和眼睛冻伤。


 数据结构
数据结构 网络
网络 关系型数据库管理系统 (RDBMS)
关系型数据库管理系统 (RDBMS) 操作系统
操作系统 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C语言编程
C语言编程 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP