二氯化铜
引言
二氯化铜是一种化学式为$\mathrm{CuCl_{2}}$的化合物。在其脱水或无水形式下,它存在于稀有矿物如埃里奥查石和托尔巴石中。它也常在火山喷气孔中发现。无水(干粉)或水合(湿润)$\mathrm{CuCl_{2}}$的两种形式呈现出两种不同的颜色——黄褐色和蓝绿色。


这种化合物在化学合成中作为催化剂。这种化合物或无机盐的另一个名称是氯化铜。
什么是二氯化铜?
二氯化铜是一种无机化合物,化学式为$\mathrm{CuCl_{2}}$。以脱水或无水形式存在于稀有矿物如埃里奥查石和托尔巴石中。$\mathrm{CuCl_{2}}$的无水形式呈黄褐色。脱水形式的
$\mathrm{CuCl_{2}}$呈蓝绿色。金属(𝐶𝑢)在$\mathrm{CuCl_{2}}$中的氧化态为+2。
二氯化铜的基本信息:
它不可燃。有时加热时会释放刺激性的氯化氢气体。
它对铝具有腐蚀性。
它在水中表现出酸性。$\mathrm{CuCl_{2}}$溶液呈酸性。原因是氯化铜溶液是由氢氧化铜和盐酸的中和反应产生的。它是弱碱和强酸反应的盐,使氯化铜的水溶液略微呈酸性。此外,溶液中氢离子的存在和低于7的pH值使$\mathrm{CuCl_{2}}$在水中呈酸性。
二氯化铜的性质
物理性质包括:
| 序号 | 物理性质 | 数值 |
|---|---|---|
| 1. | 分子量(无水) | 134.45 g/mol |
| 2. | 沸点 | 993 ℃ |
| 3. | 熔点 | 498 ℃ |
| 4. | 密度 | 3.386 g/cm³ |
| 5. | 气味 | 无味 |
化学性质包括
$\mathrm{CuCl_{2}}$可以产生多种反应,因为它是一种多用途的盐。因此,它广泛应用于化工行业的许多化学合成中。例如:
当存在还原剂时,二氯化铜会发生氧化还原反应。生成的化合物包括亚铜盐和金属铜。
二氯化铜与碱反应生成氢氧化铜和氯化钠。
$$\mathrm{2CuCl_{2}\:+\:SO_{2}\:+\:2H_{2}O\rightarrow\:2CuCl\:+\:2HCL\:+\:H_{2}SO_{4}}$$
$$\mathrm{2CuCl_{2}\:+\:2NaOH\rightarrow\:Cu(OH)_{2}\:+\:2NaCl}$$
二氯化铜的结构
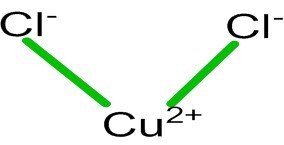
$\mathrm{CuCl_{2}}$的化学式由一个阳离子(𝐶𝑢2+)和两个阴离子(𝐶𝑙−)组成。在其脱水形式($\mathrm{CuCl_{2}}$.$\mathrm{2H_{2}O}$)中,它具有扭曲的八面体结构,其中铜金属通过两个水配体和四个氯配体键合。尽管可以通过二维表示或$\mathrm{CuCl_{2}}$的Lewis结构来表示其简单的结构。
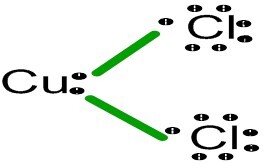
$\mathrm{CuCl_{2}}$是离子化合物的例子。离子化合物在键合时会转移电子。以下是电子转移表示:当正离子和负离子相互吸引形成离子键时,结构如下:
二氯化铜的用途
它有助于石油工业的除臭。
它作为有机和无机反应的催化剂
它作为氧化剂。
它应用于水处理。
它是摄影中的定影剂。
它应用于农业化学品的制造。
它作为纯化剂。
它在染色中用作媒染剂
它作为消毒剂。
适用于洗衣标记墨水。
二氯化铜的生产
$\mathrm{CuCl_{2}}$的粉末或无水形式是铜和氯元素结合的天然形式。
脱水$\mathrm{CuCl_{2}}$是通过进行各种反应生产的:
铜的氯化
氧化铜和盐酸的反应
氢氧化铜和$\mathrm{HCl}$的反应
碳酸铜和$\mathrm{HCl}$的反应
$$\mathrm{Cu\:Cl_{2}\:+\:2H_{2}O\rightarrow\:CuCl_{2}\:.\:2(H_{2}0)}$$
$$\mathrm{CuO(s)\:+\:2HCL(aq.)\rightarrow\:CuCl_{2}\:(aq.)+\:H_{2}O(l)}$$
$$\mathrm{Cu(OH)_{2}\:+\:HCL(aq)\rightarrow\:CuCl_{2}\:+\:H_{2}O}$$
$$\mathrm{CuCO_{3}\:+\:HCL(aq)\rightarrow\:CuCl_{2}\:+\:CO_{2}\:+\:H_{2}O}$$
健康危害
摄入二氯化铜会引起胃痛,导致流涎、恶心、呕吐和腹泻。
闻到二氯化铜会刺激喉咙、鼻子和肺,进一步导致咳嗽和打喷嚏。
当试剂接触时,二氯化铜会刺激眼睛和皮肤
吸入二氯化铜会损害肝脏和肾脏。
结论
二氯化铜是一种化学式为$\mathrm{CuCl_{2}}$的化合物。它也称为氯化铜。其干燥形式为黄褐色粉末,湿润状态则变成黄褐色到蓝绿色。它是一种多用途的盐,用于许多化学合成。虽然它有益,但它也有一些健康危害。这种有害化合物需要小心使用,因为吸入此类试剂会刺激鼻子、肺和喉咙,进一步导致咳嗽,接触会刺激皮肤、眼睛和胃,导致腹泻、恶心、流涎、呕吐和胃痛。
常见问题
1. 找出化合物$\mathrm{CuCl_{2}}$中Cu金属的氧化态?
在化合物$\mathrm{CuCl_{2}}$中,总电荷为零。因此,可以使用氧化态公式找到Cu的氧化态。设Cu上的电荷为𝑥,Cl上的电荷为−1。
$$\mathrm{CuCl_{2}\Longrightarrow\:x\:+\:2(-1)\:=\:0}$$
$$\mathrm{\Longrightarrow\:x\:-\:2\:=\:0}$$
$$\mathrm{\Longrightarrow\:x\:=\:2}$$
Cu的电荷为+2。
2. 锌与𝐶𝑢𝐶𝑙₂反应会发生什么?
反应如下:
$$\mathrm{CuCl_{2}\:+\:Zn\:\rightarrow\:ZnCl_{2}\:+\:Cu}$$
在上述反应中,金属锌被氧化成$\mathrm{Zn^{2+}}$,而$\mathrm{Cu^{2+}}$(作为氯化铜)被还原成金属铜。当将锌金属放入蓝色$\mathrm{CuCl_{2}}$溶液中时,它会获得铜涂层,使溶液的蓝色褪去并沉淀出铜。
3. 𝐶𝑢𝐶𝑙₂与𝑁𝑎𝑂𝐻反应会发生什么?
当氯化铜和氢氧化钠反应时,会形成氢氧化铜(蓝色沉淀)和氯化钠(白色沉淀)。
反应:$\mathrm{CuCl_{2}\:+\:NaOH\rightarrow\:Cu(OH)_{2}\:+\:NaCl}$
4. 为什么𝐶𝑢𝐶𝑙₂溶于水?
水分子的极性使像$\mathrm{CuCl_{2}}$这样的离子化合物溶于水中。
5. 当一块锌和氯化铜水溶液之间发生化学反应时会发生什么?说明反应类型及其原因。
当一块锌加入氯化铜水溶液中时,会形成氯化锌和铜。反应如下:
$$\mathrm{Zn\:+\:CuCl_{2}\rightarrow\:ZnCl_{2}\:+\:Cu}$$
在给定的反应中,既发生氧化又发生还原。
氧化:$\mathrm{Zn\rightarrow\:Zn^{2+}\:+\:2e^{-}}$ 还原:$\mathrm{Cu^{2+}\:+\:2e^{-}\rightarrow\:Cu}$ 因此,这是一个氧化还原反应。


 数据结构
数据结构 网络
网络 关系数据库管理系统 (RDBMS)
关系数据库管理系统 (RDBMS) 操作系统
操作系统 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C语言编程
C语言编程 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP