狄尔斯-阿尔德反应机理
简介
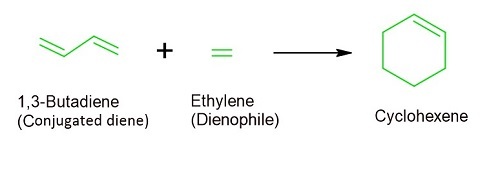
在狄尔斯-阿尔德反应机理中,共轭二烯仅与烯烃结合形成环己烯化合物。在 20 世纪中叶,德国基尔大学的研究员奥托·狄尔斯及其学生库尔特·阿尔德一直在尝试发现一种可以轻松生成更多环己烷环的机理。他们共同开发了狄尔斯-阿尔德反应,并因此获得了诺贝尔化学奖。
它常用于合成橡胶、塑料,甚至包括皮质醇和维生素 D 在内的人工类固醇。该反应实际上是一个一步过程,从 2 个分子开始,并以一个六元环结束。在整个反应过程中,3 个双键被破坏,产生了 2 个新的单键,以及 1 个新的双键。根据反应物,所得的环状六元环似乎在其周围连接有其他环,以及主要位于外侧的官能团和取代基。
什么是狄尔斯-阿尔德反应?
在狄尔斯-阿尔德反应中,共轭二烯与烯烃反应生成不稳定的六元烃。该反应有时被称为“环加成反应”,尽管它包括通过环状中间体阶段生成环状副产物。它是一个电环反应,其中共轭二烯的 4 个 π 电子以及亲双烯体的 2 个 π 电子发生 [4+2] 环加成反应。这种反应导致生成比原来的 π 键更稳定的附加 σ 键。
这种反应的一个衍生物,即杂狄尔斯-阿尔德反应,有利于六元杂环的生成。在整个反应过程中,杂原子(通常是 N 和 O)存在于二烯体和亲双烯体中。
狄尔斯-阿尔德反应机理
由于 π 键已转化为更强的 σ 键,因此该过程在热力学上是有利的。具有电子钝化基团的亲电子亲双烯体是狄尔斯-阿尔德反应的合适选择。它也吸引含有给电子基团的亲核二烯体。以下是狄尔斯-阿尔德反应的一些有效二烯体和亲双烯体的例子。

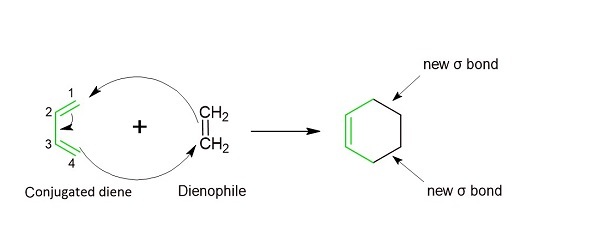
由于机理是同步的,因此狄尔斯-阿尔德反应似乎是一个一步环加成反应。如果 2 个不饱和分子结合在一起,它们会生成一个环状加合物。键数净减少。所有键的形成和断裂同时发生。下图说明了这个基本反应机理。二烯和亲双烯体之间的反应产物得到环己烯变体。如方法图所示,3 个 C=C π 键断裂,只形成 1 个 π 键,同时形成 2 个 σ 键。
立体选择性和变体
狄尔斯-阿尔德反应有几个变体,如下所示 -
杂狄尔斯-阿尔德变体 - 所有这些反应都包含 1 个或多个杂原子。当羰基与二烯体结合时,会形成二氢吡喃。在氮杂狄尔斯-阿尔德反应中,亚胺可用作亲双烯体。作为这种反应的结果,形成了一个 N-杂环分子。当使用亚硝基分子作为亲双烯体时,由于与二烯体相互作用,会生成恶嗪。
路易斯酸应用 - 在此变体中,路易斯酸作为催化剂。它可用于包括 AlCl3、BF3、SnCl4 和 ZnCl2 在内的反应中。路易斯酸增加了亲电性。这种变体具有更快的反应时间以及更高的立体选择性和区域选择性。仅限于低温狄尔斯-阿尔德反应。
不对称变体 - 一系列变量会影响该反应的立体选择性。但是,此示例涉及使用手性助剂。含有相对较小分子的有机催化剂也可用于改变反应的立体选择性。它具有许多重要的应用,例如维生素 B6 的合成以及环戊二烯及其可逆反应的商业开发。
六脱氢狄尔斯-阿尔德 - 即使没有二烯体和烯烃,在此反应中也使用了二炔体或炔烃,从而产生不稳定的苯炔加合物,随后可以回收以产生杂环化合物。这种反应还允许在一个步骤中生成广泛的双官能团芳香环。
狄尔斯-阿尔德反应的应用
狄尔斯-阿尔德反应可用于制备以下化合物 -
利用芳炔与双官能团非环状二烯的新型狄尔斯-阿尔德反应,经常解释重要的顺式取代二氢萘基本单元的制备。
多碳环和多杂环存在于天然和人造形式中。
许多生物碱是修饰的喹啉以及其他具有吡咯并喹啉和环戊并喹啉环结构的 N-多杂环。
1,8-二氮杂-9,10-蒽醌化合物的对称修饰。
由 N-甲苯磺酰基 (S, R)-甲基色氨酸合成的恶氮杂环硼烷催化了两种溴丙烯醛和呋喃的对映选择性狄尔斯-阿尔德生物合成。作为该反应的结果,产生了手性 7-氧杂双环[2.2.1]庚烯类似物。
结论
狄尔斯-阿尔德反应是共轭二烯与烯烃之间的环加成反应。这种反应导致形成 1,4-加成产物。虽然二烯上存在吸电子基团,以及亲双烯体上存在给电子基团(虽然它是一个基团,也许是一个键,被吸引到二烯体上),但会促进狄尔斯-阿尔德反应。该反应的过程表明,它不会通过碳正离子中间体进行。然而,该反应是通过周环反应进行的,其中涉及电子对的环状重排。在特定的顺式加成反应中,二烯体和亲双烯体的初始立体化学得以保留。存在立体专一的狄尔斯-阿尔德反应。在整个反应过程中,取代基连接到二烯体或亲双烯体上,并保留其手性分子。
常见问题
1. 什么导致狄尔斯-阿尔德反应的放热和自发性?
在反应物中消除三个 π 键,同时在产物中形成两个 σ 键和一个 π 键,会产生负的焓值,表明该反应是放热和自发的。
2. 狄尔斯-阿尔德反应中内型和外型有什么区别?
当 2 个环状环在狄尔斯-阿尔德反应中结合时,它们之间会形成一个第 3 个环。2 个初始环可以以多种方式相互作用,从而导致不同的立体化学结果。这 2 个结果分别称为“外型”和“内型”加成。
3. 什么导致狄尔斯-阿尔德反应具有立体专一性?
该过程是立体专一的,因为亲双烯体的立体化学在环己烯产物中得以保留:反式亲双烯体生成反式产物,顺式亲双烯体生成顺式产物。
4. 为什么狄尔斯-阿尔德反应可以逆转?
这是一个可以逆转的化学反应。虽然初始元素的熵高于产物,但在给定足够高的温度下,所有狄尔斯-阿尔德反应都可以逆转为起始二烯体和亲双烯体。
5. 为什么狄尔斯-阿尔德反应倾向于内型?
内型产物在热力学上是优先的,因此表明它是在低温以及有限时间条件下产生的主要产物。这是因为内型产物的合成平衡位置效率较低,导致次级轨道重叠。


 数据结构
数据结构 网络
网络 RDBMS
RDBMS 操作系统
操作系统 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C 语言编程
C 语言编程 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP