分子间力的不同类型
引言
分子间力是构成所有分子间相互作用的基础力。这些相互作用比分子内力弱。分子间吸引力 (IMF) 的强度决定了两种分子之间将发生的相互作用类型,以及这些相互作用将引起的改变。在考虑分子间吸引力 (IMF) 时,最常见的参考是水 (H₂O) 分子。分子间力 (IMF) 决定物质的物理特性。此外,水 (H₂O) 是少数几种可以同时存在于三种状态(固态、液态和气态)的化合物之一。
什么是分子间力?
“分子间力 (IMF)”一词指的是原子之间的静电力 (EF) 吸引甚至排斥,因为形容词“inter”意味着“在…之间”。另一种用于形成分子的原子之间存在的力的说法是“分子内力”。例如,“国际的”和“国际的”分别指的是两个或多个国家之间的相互作用。分子间力 (IMF) 是原子之间存在的力。这些力包括偶极-偶极 (d-d) 相互作用、离子-偶极 (I-d) 相互作用、离子-诱导偶极 (I-Id) 相互作用、范德华力 (VDW),包括氢 (H) 键。这些力是计算物质的物理特性(如密度、焓、熔点 (M.P.)、沸点 (B.P.)、汽化等)所必需的。IMF 比分子内力(如离子键或共价键)弱得多。
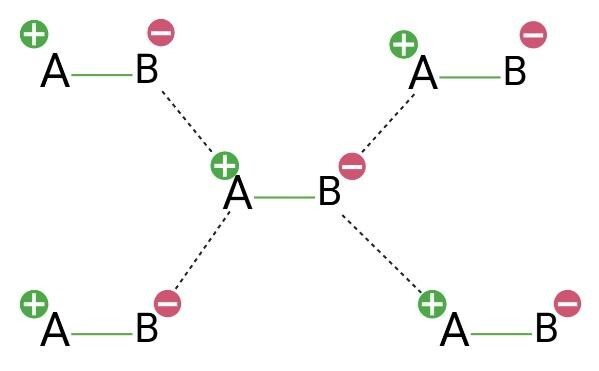
分子间力的不同类型是什么?
它们大致分为三种类型——范德华力 (VDW)、偶极-偶极 (d-d) 相互作用和氢键。然而,指的是伦敦色散力 (LDF) 的诱导偶极子的说法,被进一步分类。这导致了五种不同的分子间力 (IMF) 形式。
偶极-偶极力 (d-d 力)
离子-偶极相互作用 (I-d 相互作用)
离子-诱导偶极相互作用 (I-Id 相互作用)
范德华力
氢键
偶极-偶极相互作用
这种类型的相互作用是由化合物之间的部分正电和负电侧引起的。分子的负电侧吸引其他分子的正电侧,导致形成称为分子间偶极-偶极相互作用的静电力 (EF) 吸引。这种类型的静电吸引比离子-离子接触弱。由于偶极相互作用基于部分电荷,因此离子相互作用基于被称为阳离子和阴离子的永久正电荷和负电荷。
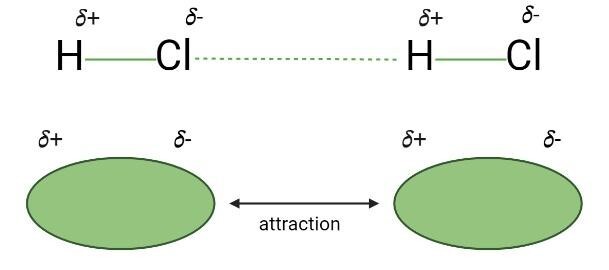
盐酸 (HCl) 相互作用是偶极-偶极力的例子。H 原子部分带正电,而 Cl 原子部分带负电。当部分带负电的 Cl 原子吸引来自相邻分子的部分带正电的氢 (H) 时,就会产生一个大型的类似连接网络。氢化硫 (H₂S)、二氧化氮 (NO₂)、水 (H₂O)、二氧化硫 (SO₂)、EDTA(乙二胺四乙酸)、氨 (NH₃) 和其他极性分子是唯一可以发生偶极-偶极相互作用的分子。这些相互作用受极性分子特性的影响。
离子-偶极相互作用
当离子与极性化合物相互作用并形成相互作用力时,就会产生这些相互作用。极性分子具有部分正电荷和负电荷,因此当带有正电荷或负电荷的离子接近它们时,它们之间会产生静电力 (EF)。由于相反的电荷相互排斥而相似的电荷相互吸引,因此离子总是被吸引到极性化合物相反带电的一端。
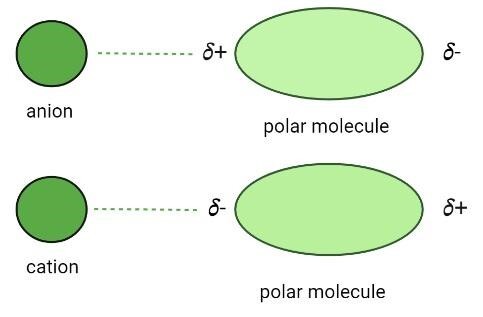
当氯化钠 (NaCl) 加入水中时,水 (H₂O) 分子与钠离子和氯离子结合。水通过离子-偶极相互作用将离子物质分解成离子的能力被称为水合作用。
离子-诱导偶极相互作用
离子控制离子-诱导相互作用。当离子接触非极性物质时,它会导致物质产生部分正电和负电极,将其转化为偶极构型。换句话说,离子在非极性分子上产生偶极矩,导致它们变成极性分子。金属离子接近氧 (O) 和其他分子并导致其中产生净偶极矩是这种相互作用的例子。
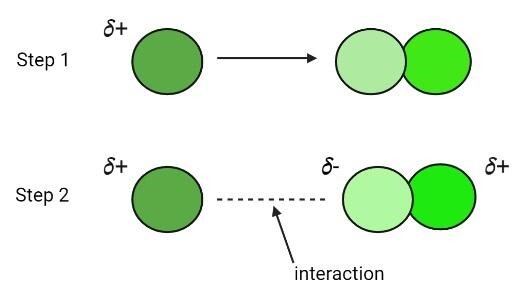
如果使用离子产生偶极子,则产生的力被称为离子-诱导偶极相互作用。但是,如果这些相互作用发生在现有的极性分子和非极性分子之间,则它们被称为偶极-诱导偶极相互作用。例如 (NO⁻),
结论
IMF 是物质之间存在的吸引力和排斥力。它们是分子和原子之间存在的静电力。各种物质的沸点 (B.P.) 与它们的分子间力 (IMF) 有关。最弱的力是伦敦力或色散力。与偶极-偶极相互作用一样,离子-偶极相互作用发生在离子与极性原子之间。
常见问题解答
1. 为什么液体的粘度随着温度的升高而降低?
这样,在高温下,物质的分子获得高动能,但可以克服分子间相互作用,在各层之间相互滑动,液体的粘度降低。
2. 晶体的熔点 (M.P.) 的大小反映了它的稳定性。解释一下?
固体的熔点 (M.P.) 描述了在物质组分之间起作用的分子间力。当这些力很大时,组分的熔点较高;当这些力低时,组分的熔点低。固体的熔点越高,它就越稳定。
3. 在熔融状态或水溶液中,离子固体是良好的导体,但在固态下不是。为什么?
由于结构坚硬和静电力强,离子固体中的离子在固态下不能自由移动。因此,它们在熔融时不能导电,但在水溶液中,离子可以自由移动,从而导电。
4. 哪些力导致液体的粘度?是什么导致甘油比水 (H₂O) 粘度更大?
导致液体粘度的力包括氢 (H) 键和范德华力 (VDW)。甘油比水 (H₂O) 粘度大得多,因为甘油的原子由于其中存在三个醇基而比水的原子具有更多的氢键。
5. 晶体的熔点 (M.P.) 的大小反映了它的稳定性。使用数据手册,收集固态水、乙醇、乙醚和甲烷的熔点 (M.P.)。关于这些分子的分子间力 (IMF) 可以说些什么?
物质的熔点 (M.P.) 越高,其分子间吸引力越强,稳定性越好。熔点 (M.P.) 较高的物质比熔点 (M.P.) 较低的物质更稳定。
乙醚 = -116.3°C
甲烷 = -183.81°C
固态水 = -0.15°C
乙醇 = -114.35°C
根据所提供组分的数值,固态水中的分子间力 (IMF) 最高,而甲烷中的最低。


 数据结构
数据结构 网络
网络 关系数据库管理系统 (RDBMS)
关系数据库管理系统 (RDBMS) 操作系统
操作系统 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C语言编程
C语言编程 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP