电化学电池
引言
电化学电池是一种能够从自发化学反应中产生电能的系统。让我们进一步讨论它:
手机电池在插入充电器时是如何充电的?电视遥控器中的电池又是如何工作的?在电化学这个科学领域,所有这些疑问都有答案。电化学的研究包括利用电力进行非自发化学反应以及通过化学反应产生电力。电池被用来实现这个目标。电池是导致化学反应产生电力或产生电力的组件。
什么是电化学反应?
任何由电流流动引起或伴随电流流动的过程,通常涉及两种物质(一种是固体,另一种是液体)之间的电子转移,都被认为是电化学反应。固体电极和一种物质(如电解质)相互作用发生电化学反应。通过在电极之间产生电流,这种流动导致反应释放或吸收热量。例如,当与彼此接触的两个电极触发氧化还原(redox)反应时,反应中涉及的所有原子的氧化数都会发生变化。
电化学反应的过程
带负电的电子的特性决定了物质如何与流经系统的电流相互作用。由于质子是带正电的物质单位,可以在元素、原子组或分子中找到,因此电子作为电的基本单位,对其具有很强的吸引力。
粒子彼此之间的化学吸引力与这种吸引力相似。每个化学反应都会导致原子电子结构的变化,这些释放的电子可以与物质粒子结合形成还原反应,或者被它们释放(氧化)。法拉第定律规定了电流流动中的自由电子与其中引发反应的物质原子之间的定量关系。电化学过程的组分,通常称为离子导体或电解质
什么是电化学电池?
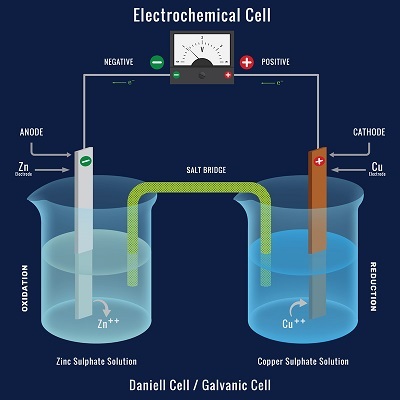
能够从自发化学反应中产生电能的系统就是电化学电池。在这个过程中发生的化学反应是氧化还原反应。在氧化还原反应中,电子在化学物质之间转移。它们也称为伽伐尼电池或伏打电池。丹尼尔电池就是一个电化学电池的例子。
电化学电池的基本组成部分包括:
电解质——是在电极之间发现的一种物质,当溶解在像水这样的极性溶剂中时,会产生自由流动的离子,从而产生导电溶液。
电极——是电化学电池中使用的固体导电体,由良好的导体(如金属)制成。
阴极 - 电池中发生还原反应的区域。
阳极 - 电池中发生氧化反应的区域。
盐桥 - 电化学电池的氧化和还原半电池通过盐桥连接,完成电路。它充满了KCl和其他饱和盐溶液。桥梁对于溶液中的离子在半电池之间流动是必要的,这是必需的。
它们有两种类型:
电化学电池的类型有哪些?
主要有两种类型:
伽伐尼电池/伏打电池——在这些电化学电池中,化学能转化为电能。
电解电池——在这些电池中,电能转化为化学能。
解释工作原理
工作原理
电化学系统的基本工作原理是在其中发生的氧化还原反应产生的电子转移,从而产生电流。
工作机制
当电化学电池组装完成后打开开关时,在外电路的检流计上可以看到偏转。检流计的指针向盛有硫酸铜溶液的烧杯方向移动。这表明电流是从硫酸铜溶液烧杯流向硫酸锌溶液烧杯。当电路闭合时,发生变化,导致锌电极中的锌原子氧化,铜棒中的铜原子还原。锌释放两个电子,铜通过外电路接受它们。
$$ \mathrm{总氧化还原反应:Zn(s) + Cu^{2+}(aq) \rightarrow Zn^{2+}(aq) + Cu(s)} $$
如何计算电化学电池电势?
反应的电化学电池电势通常被称为电池的标准电动势。电化学电池是基于一个可以分为两个半反应的过程:还原半反应和氧化半反应。
还原半反应 - 通过获得电子形成金属。
氧化半反应 - 通过失去电子形成阳离子。
让我们来看一下锌和铜的例子:
$$ \mathrm{Zn(s) + Cu^{2+}(aq) \rightarrow Zn^{2+}(aq) + Cu(s)} $$
这些铜离子在阴极附近转变为铜金属,然后进一步沉积。公式是
$$ \mathrm{Cu^{2+} + 2e^{-} \rightarrow Cu(s)} $$
电池表示法如下:
$$ \mathrm{Zn | Zn^{2+}(aq) || Cu^{2+}(aq) | Cu} $$
电池的阴极和阳极分别位于其右侧和左侧。
阴极和阳极的标准电动势之差构成电化学反应电池的标准电动势。
公式如下:
$$ \mathrm{E^{0}_{cell} = E^{0}_{cathode} - E^{0}_{anode}} $$
如果反应发生的环境不是标准条件,则可以使用以下公式:
$$ \mathrm{E_{cell} = E^{0}_{cell} - \frac{RT}{nF}lnQ} $$
其中n表示反应中涉及的电子数,T表示温度,F表示法拉第常数,Q表示反应商。
电化学电池的应用
在冶金学中,许多有色金属通过电解电池进行电精炼,从而生产出非常纯净的金属,如Pb、Zn、Al和Cu。这些金属是使用电解电池电解提取的。
通过将其储存在电解电池中,它被用来从熔融NaCl中回收纯Na金属。
在助听器中使用氧化银电池。
在海军设备中,热电池用于军事应用。
电化学反应的例子
无论何时使用水溶液。最简单的氧化还原反应如下:
在阴极 - $ \mathrm{2H_{2}O + 2e^{-} \rightarrow H_{2} + 2OH^{-}(水被还原)} $
在阳极 - $ \mathrm{2H_{2}O \rightarrow 4H^{+} + O_{2} + 4e^{-}(水被氧化)} $
当使用活性金属作为阳离子时,$ \mathrm{H_{2}O} $在阴极被还原。当阳离子是多原子离子时,水在阳极被氧化。
腐蚀是电化学过程的另一个很好的例子。当裸露的铁与水分接触时,由于电化学反应,铁会迅速生锈,其中水滴变成一个微小的伽伐尼电池(它氧化铁)。
电化学应用
利用电池的概念可以制造蓄电池。电池是科学和技术中使用的装置,它储存化学能并以电的形式提供能量。
国防应用(热电池)
电子摄像机(锂电池)
音频设备(氧化银电池)
电镀用途广泛,包括珠宝制造和保护某些金属免受腐蚀。
电化学在许多行业中是必需的,包括氯碱工业。
结论
电化学的研究是引人入胜的。电化学反应很重要,因为它们具有巨大的学术和实践意义。理解这些反应有助于我们理解日常用品(如电池)的工作原理。电化学电池可以利用化学反应产生的化学能来产生电能,而电能也可以用来产生化学能。
常见问题
1. 丹尼尔电池和伏打电池有什么区别?
根据提供的或汲取的电流,伏打电池可能是可逆的,也可能不是可逆的,而丹尼尔电池总是可逆的。
2. 哪些因素会影响电极电势?
电极获取电子的能力称为还原电势,而氧化电势是指电极失去电子的趋势。温度和电极表面的金属离子浓度决定了它的电势。
3. 如何根据吉布斯自由能确定标准电池电势?
在伽伐尼电池中,吉布斯自由能与电势的关系由公式 $ \mathrm{G^{0}_{cell} = nFE^{0}_{cell}} $ 表示。如果 E°cell > 0,则反应可以发生。
4. 可以用锌罐盛放硫酸铜溶液吗?
铜的活性低于锌。因此,锌可以从其盐溶液中置换出Cu。如果将 $ \mathrm{CuSO_{4}} $ 溶液储存在锌容器中,铜将从溶液中置换出来。
$$ \mathrm{Zn + CuSO_{4} \rightarrow ZnSO_{4} + Cu} $$
因此,不能用锌罐盛放硫酸铜溶液。
5. SI系统中电动势的测量单位是什么?
电池每库仑电荷所含的能量称为电动势 (EMF),其 SI 单位为伏特 (V),等于焦耳每库仑。


 数据结构
数据结构 网络
网络 关系数据库管理系统 (RDBMS)
关系数据库管理系统 (RDBMS) 操作系统
操作系统 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C语言编程
C语言编程 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP