原电池和电解池的区别
电池是一种能够将化学能转化为电能的装置。电池由两个电极和内部的化学物质组成。当电池连接到电路时,电池内部会发生化学反应,这些化学反应的结果是在电路中产生电流。
在本文中,我们将讨论原电池和电解池,以及这两种类型的电池彼此之间有何不同。
什么是原电池?
原电池是一种电化学电池,它利用自发的氧化还原反应产生电流。
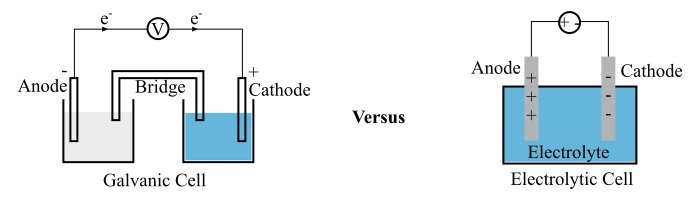
原电池由两个半电池组成,每个半电池都包含一个浸在电解质中的电极。这两个电极彼此分离,以防止氧化和还原反应直接接触,从而产生电位差。
当原电池的电路闭合时,氧化反应中释放的电子会通过外部电路到达另一个电极,最终这些电子会被还原反应利用。通过这种方式,原电池在外部电路中建立电流。
什么是电解池?
电解池也是一种电化学电池,它利用来自外部电源的电能来驱动化学反应。
一个典型的电解池主要有三个部分:两个电极(阳极和阴极)和一个电解质。其中,电解质是水和熔融盐(例如氯化钠)的溶液,其中溶解了离子。
当电压施加到电极上时,电解质中的离子会被吸引到极性相反的电极。电解池被广泛用于电解分解化合物。
原电池和电解池的区别
原电池和电解池都是电化学电池的类型。然而,原电池和电解池之间存在许多差异,在下表中列出:
| 差异依据 | 原电池 | 电解池 |
|---|---|---|
| 定义 | 原电池是一种电化学电池,其中化学能转化为电能。 | 电解池是一种电化学电池,其中电能转化为化学能。 |
| 能量转换 | 在原电池中,化学能转化为电能。 | 在电解池中,电能转化为化学能。 |
| 电极极性 | 对于原电池,正极称为阴极,负极称为阳极。 | 对于电解池,阳极为正极,阴极为负极。 |
| 电子流动 | 带负电的电子从原电池的阳极流向阴极。 | 电子从电解池的阴极流向阳极。 |
| 化学反应 | 在原电池中发生自发的化学反应以释放电能。 | 在电解池中,发生非自发的化学反应。 |
| 是否需要外部电压源 | 原电池不需要外部电压源。 | 电解池需要外部电压源。 |
| 电能流动 | 在原电池中,电能从电池流向外部电路。 | 在电解池中,电能从外部电路流向电池。 |
| 电池容器数量 | 原电池需要两个单独的电池容器,形成两个由盐桥连接的半电池。 | 一个电池容器构成完整的电解池。 |
| 电极上的离子 | 在原电池中,离子在阴极放电,在阳极消耗。 | 电解池的两个电极都会放电离子。 |
| 氧化和还原反应 | 在原电池中,氧化反应发生在阳极,还原反应发生在阴极。 | 在电解池中,氧化反应发生在阴极,还原反应发生在阳极。 |
| 应用 | 原电池用作电源,用于电池等。 | 电解池用于电解提纯金属等。 |
结论
原电池和电解池之间最显著的区别在于,原电池将化学能转化为电能,而电解池将电能转化为化学能。

广告

 数据结构
数据结构 网络
网络 RDBMS
RDBMS 操作系统
操作系统 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C 编程
C 编程 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP