热容:Cp 和 Cv 之间的关系
介绍
热容或热容量是指改变物体温度 1 个单位所需的热量。热容是材料的内在属性,也可以描述为系统吸收热量与温度变化的比率。
定义热容
当物体吸收热量时,温度升高;当释放热量时,温度下降。物体的温度衡量的是构成该物体的组分的总动能。当物体吸收热量时,它会转化为粒子组分的动能,导致温度升高。因此,温度变化与热传递成正比。
使 1 摩尔任何物质的温度发生 ΔT 变化所需的热量 Q 由公式 Q=mCΔT 表示。这里的常数 C 称为物体的摩尔热容。因此,任何物体的摩尔热容被定义为使 1 摩尔该物体的温度改变 1 个单位所需的热能。它取决于系统的类型、大小和组成。
什么是热容 C、Cp 和 Cv?
比热容 (C)
任何材料的比热容被定义为“使单位质量的材料温度改变 1 度所需的热量”。
Q=mCΔT
因此,比热容 C=Q/mΔT
它的单位是焦耳每开尔文千克,或 J/(KgK)
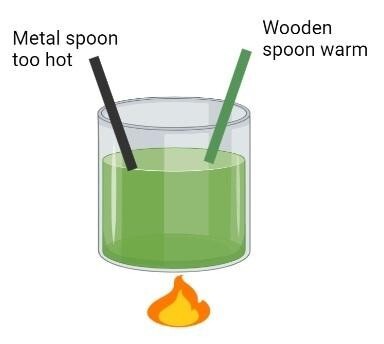
恒压 (Cp)
摩尔恒压热容或 Cp 定义为在恒定压力下,单位质量的材料在温度发生变化时产生的或吸收的热能。
在持续压力下,δQ=dU+PdV(等压过程)
Cp 可以表示为 -
$$\mathrm{Cp=[dH/dT]p}$$
其中
Cp 表示恒压比热。
dH 表示焓变。
dT 表示温度变化。
恒容 (Cv)
摩尔恒容热容缩写为 Cv,是指在恒定体积下,物体在温度发生微小变化时,每单位质量释放/吸收的热量。
在恒定体积下,dV=0,δQ=dU(等容过程)
Cv 可以写成 -
$$\mathrm{Cv=[dU/dT]v}$$
其中,
Cv 是恒定体积下的比热,而 dU 是系统内能的微小变化。
Cp 和 Cv 之间的关系
热力学第一定律指出
Q=nCmΔT......(1)
方程 1 在恒定压力 P 下变为
$$\mathrm{qP=nCpΔT}$$
此值等于焓变,即
qP=nCpΔT=ΔH......(2)
类似地,在恒定体积 V 下,
$$\mathrm{qV=nCvΔT}$$
此值等于内能的变化,即
qV=nCvΔT=ΔU......(3)
1 摩尔 (n=1) 理想气体,
$$\mathrm{ΔH=ΔU+Δ(PV)}$$
$$\mathrm{ΔH=ΔU+Δ(RT)}$$
重新排列前面的方程得到
$$\mathrm{ΔH=ΔU+RΔT}$$
因此,ΔH=ΔU+RΔT
在前面的方程中,从方程 (2) 和 (3) 中代入 ΔH 和 ΔU 的值。(1),
$$\mathrm{nCpΔT=nCvΔT+RΔT}$$
对于 (n=1),上述方程可以表示为 -
$$\mathrm{CpΔT=CvΔT+RΔT}$$
使用 ΔT 作为公因子,然后
$$\mathrm{Cp×ΔT=(Cv+R)ΔT}$$
通过从两边去除 ΔT,
$$\mathrm{Cp=Cv+R}$$
$$\mathrm{Cp-Cv=R}$$
为什么 Cp 大于 Cv?
Cp 和 Cv 表示理想气体的比热。它们表示使单位质量的温度升高 1 度所需的热量。
根据热力学第一定律,
$$\mathrm{ΔQ=ΔU+ΔW}$$
其中,
ΔQ 是输入物体的热量,U 是内能的变化,W 是所做的功。
在恒定压力下,吸收的热量不仅用于提高内能,还用于做功。在恒定体积下,吸收的热量仅用于提高内能,而不做任何功,因为(对于封闭系统)
$$\mathrm{W=PΔV}$$
其中 W 是完成的功。这里,
$$\mathrm{ΔV=0}$$
(封闭系统也是恒定体积的重要条件之一)。因此,恒压比热大于恒定体积下的比热,即
$$\mathrm{Cp>Cv }$$
结论
摩尔热容的 SI 单位是焦耳每开尔文摩尔 (J/Kmol),通常称为 JK-1 mol-1。量热计是测量热量的工具。由于热量是在恒定压力下传递的,因此恒压摩尔热容 Cp 总是大于恒定体积摩尔热容 Cv。热膨胀是指物体尺寸随温度升高而增大的现象。
常见问题
1.如何利用给定材料的比热容计算热容?
Q=mCΔT
2.在国际单位制 (SI) 中,比热容和热容分别是什么单位?
热容和比热容的 SI 单位分别是焦耳每开尔文 (J/K) 和焦耳每千克开尔文 (J/KgK)。
3.如果我们有 3.5 千克的水。如果水的比热为 4180 J/Kg0C,则水的热容是多少?
$$\mathrm{c = 4180 \frac{J}{Kg}^\circ C}$$
m = 3.5 kg
$$\mathrm{Q=mC}$$
= 3.5×4180
$$\mathrm{= 14630 \frac{J}{^\circ C}}$$
4.一块 600 克的铜块在 300C 到 800C 的温度范围内被加热。如果铜的比热为 0.385 J/g0C,则计算加热铜所需的能量。
$$\mathrm{c = 0.385 \frac{J}{g}^\circ C}$$
$$\mathrm{ΔT = (80–30)^\circ C= 50^\circ C}$$
我们知道,Q=mCΔT
= 600 × 0.385 × 50
= 11550 J
5.一个重 35 克的金属球在 $\mathrm{100^\circ C}$ 的温度下用 2000 J 的能量加热。确定金属球的比热。
m = 35 gm
$$\mathrm{ΔT = 100^\circ C}$$
Q = 2000 J
将这些值代入 Q=mCΔT
$$\mathrm{2000 J = (35 g) c (100^\circ C)}$$
$$\mathrm{2000 J = (3500g^\circ C) c}$$
两边都除以 3500 g0C
$$\mathrm{2000 J/ 3500^\circ C= c}$$
$$\mathrm{c = 0.571 \frac{J}{g}^\circ C}$$
6.比热容和热容有什么区别?
比热容和热容在几个方面有所不同。主要区别在于比热容不依赖于材料的质量,而热容则依赖于材料的质量。
7.130 克铁的比热为 $\mathrm{0.45 J/g^\circ C}$。铁制品在 $\mathrm{100^\circ C\: 到\: 500^\circ C}$ 的温度范围内被加热。确定所需的热能。
质量 (m) = 130 g
铁的比热 (C) = $\mathrm{0.45\frac{J}{g}^\circ C}$
温度变化 (ΔT) = 500 – 100 = 4000C
$$\mathrm{Q=mCΔT}$$
$$\mathrm{Q = 130g × 0.45\frac{J}{g}^\circ C × 400^\circ C}$$
Q = 23400 J
因此,130 克铁的热容为 23400 J。


 数据结构
数据结构 网络
网络 关系数据库管理系统 (RDBMS)
关系数据库管理系统 (RDBMS) 操作系统
操作系统 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C 编程
C 编程 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP