电离焓
介绍
电离能 (I.E.) 被描述为从孤立的气态 (g) 原子、正离子或分子中去除 (弹出) 最松散 (最弱) 束缚的电子 (e) 所需的最小 (min) 能量 (e)。电离能 (I.E) 在现代周期表中遵循周期性。正常的或一般的趋势是,电离能 (I.E) 从左 (l) 到右 (r) 沿周期 (p) 增加。并且,从上 (t) 到下 (b) 沿族 (g) 移动时,电离能降低或减少。电离能 (I.E.) 也有一些例外情况。
什么是电离能?
电离能简单地可以定义为从任何原子或离子中去除 (弹出) 电子的难易程度的衡量,或者也可以认为是原子 (a) 或离子去除电子的趋势 (能力)。电子的损失 (缺乏) 通常发生在化学物质的基态。
电离能 (I.E.) 是电子占据其位置的强度或能力(吸引力)的衡量标准。电离能也可以描述为气态 (g) 原子或离子中的电子需要吸收的最小 (min) 能量,以摆脱原子核的 (力) 影响。有时,它也被认为是电离势,并且是一个吸热过程。
电离能公式
最简单的元素氢 (H) 的电离能或电位可以通过以下方程确定或计算或找出 -
$$\mathrm{E= hcR_H (1/n^2), 其中}$$
E 表示电子的能量 (e) 或去除 (弹出) 电子 (e) 所需的能量 (e) 量,即电离能 (I.E.),h 表示普朗克常数,其值为 6.626×10-34 Js(焦耳秒),c 表示光速,它是一个常数项,其值为 3.0*108 m/s,R_H 表示里德堡常数 = 1.097×107 m-1,n 是主 (p) 量子 (q) 数或我们可以说电子的能级 (e)。现在,将所有这些值代入方程,我们将得到 - $\mathrm{ E=(2.18*10^{-18} J)(1/n^2)}$。周期表中的电离能趋势
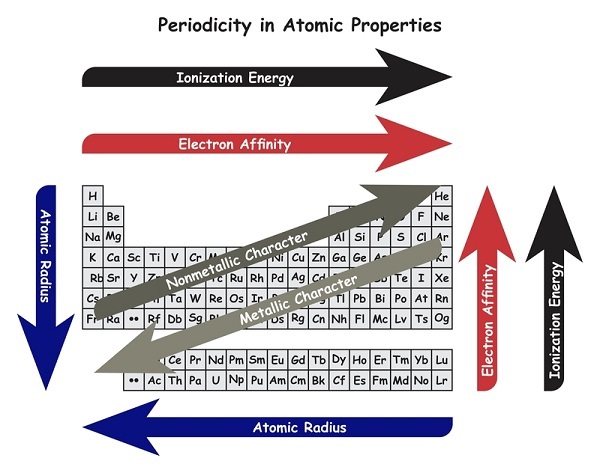
电离能的一般趋势是
族中电离能的趋势 - 元素的电离能 (I.E.) 或第一 (1st) I.E. 随着我们从上 (t) 到下 (b) 沿族移动而降低 (减少),因为原子序数沿族增加,电子层 (s) 的数量也增加。最外层电子 (e) 远离原子核,因此更容易去除。
周期中电离能的趋势 - 当我们沿着周期 (p) 从左 (l) 到右 (r) 移动 (位移) 时,元素 (e) 的电离能 (I.E) 增加。这是因为原子 (a) 的尺寸 (s) 沿周期减小。在这里,由于核电荷增加,价电子 (e) 变得更靠近原子的原子核。
第一、第二和后续电离能
第一 (1st) 电离能 - 它被描述为从气相中性原子 (a) 中去除 (弹出) 最外层 (o) 或我们可以说最高 (更高) 能量电子 (e) 所需的能量 (e)。
第二电离能 - 它被描述为从元素 (e) 的 1+ 离子中去除最外层或我们可以说最少束缚的电子 (e) 所需的能量 (e)。元素的第二 (2nd) 电离能 (e) 总是高于第一电离能。
后续电离能 - 它被描述为依次去除电子 (e) 所需或需要的能量 (e)。它还取决于最外层或最外层 (o) 电子层中存在的电子 (e) 的数量 (no.)。
电离能趋势的例外情况
大体上,电离能趋势有两个例外。硼 (B) 的第一 (1st) 电离能 (I.E.) 小于铍 (Be) 的第一 (1st) 电离能 (I.E.),并且氧 (O) 的第一 (1st) 电离能 (I.E.) 小于氮 (N) 的第一 (1st) 电离能 (I.E.)。这种差异背后的原因是这些元素的电子构型和著名的洪特规则。
价态
价态被定义或描述为原子或原子组与另一个原子 (a) 或原子组形成键合 (化学) 的能力。元素的价态可以通过最外层或价电子层中电子的数量 (no.) 来确定。
价态及其周期性趋势
1 族元素只有一个价 (v) 电子 (e),因此它们具有 +1 的价态 (v),因为它们即将给出或失去 1 个电子 (e)。
类似地,2 族元素可以失去 2 个电子 (e),而 3 族元素可以失去 3 个电子。
5 族元素含有 5 个价 (v) 电子,它将倾向于只接受其中的 3 个,因此具有 -3 的价态 (v)。
类似地,6 族 (VI) 元素 (e) 具有 -2 的价态,7 族元素具有 -1 的价态 (v),而 8 族 (VIII) 元素 (e) 不反应,因此具有 0 的价态或值。
结论
电离能用 (I.E.) 表示,被描述为从孤立的气态 (g) 原子、正离子或分子中去除 (弹出或失去) 最松散 (最弱) 束缚的电子 (e) 所需的最小 (min) 能量 (e)。电离能 (I.E) 在现代周期表中遵循周期性。正常的或一般的趋势是,电离能 (I.E) 从左 (l) 到右 (r) 沿周期增加。并且,从上 (t) 到下 (b) 沿族 (g) 移动时,电离能降低或减少。电离能 (I.E.) 也有一些例外情况。
常见问题
1. 孤立的气态原子是什么意思?
孤立的气态原子被定义为在气态 (g) 状态下不受任何其他原子影响的原子 (a)。
2. 定义周期性。
当元素 (e) 按原子序数 (Z) 增加的顺序排列时,元素 (e) 在一定时间间隔后类似 (相同) 性质的周期性 (p) 重复称为周期性。
3. 描述洪特规则。
洪特规则描述了在任何一个 (1) 轨道 (o) 被双 (2) 填充之前,每个 (单个) 轨道 (o) 在一个亚层 (s) 中都被一个电子 (e) 单 (1) 填充,并且所有单 (1) 填充轨道 (o) 中的电子 (e) 具有相同的自旋。
4. 沿周期,电离能增加还是减少。
沿周期,电离能 (I.E.) 增加。
5. 电离能是什么类型的过程?
电离能始终是一个吸热过程。


 数据结构
数据结构 网络
网络 关系型数据库管理系统
关系型数据库管理系统 操作系统
操作系统 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C 语言编程
C 语言编程 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP