平衡态变化实验过程
引言
当系统受到干扰时,就会观察到平衡状态的变化。然而,平衡态变化实验是在实验室受控条件下进行的。勒夏特列原理阐述了平衡态变化的概念,并与平衡常数相关联。反应中的平衡态变化对平衡状态的影响相当显著。可以据此预测反应方向的变化。
勒夏特列原理
在化学反应中,可以通过改变反应条件来改变化学平衡的状态。平衡状态的变化称为**胁迫**。因此,如果对给定系统的平衡状态施加胁迫,则反应将不再处于平衡状态。
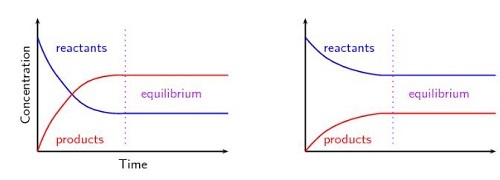
图1 - 勒夏特列原理的图形表示
根据勒夏特列原理,增加或减少产物或反应物的摩尔数、压力、温度以及平衡反应中任何其他变化都会导致显着的变化,同时向前或向后移动以释放胁迫。
平衡常数
平衡常数是描述任何反应平衡状态的必要方面。产物分子浓度与反应物分子浓度的比率称为平衡常数。然而,在特定温度下,平衡速率保持不变。
目的和目标
下面提到的实验的目的是为了理解平衡态的变化,以展示反应平衡和平衡常数之间的关系。然而,实验中考虑的是铁离子和硫氰酸根离子的反应,其中增加或减少离子的浓度以观察胁迫对反应平衡状态的影响。
所需材料
此实验室实验需要某些特定材料,如下所述:
实验中使用了陶瓷制成的点板、两根玻璃搅拌棒、一块热板和一个250毫升的废液收集烧杯。需要MicroLab分光光度计和四个MicroLab分光光度计小瓶。

图2 - “所需材料”
将0.100克氯化铁溶液加入0.100克硫氰酸钾中,然后进一步加入去离子水。
步骤
在这个实验中,采取了一些步骤来获得正确和准确的读数,并采取了预防措施。如果测量不正确,则实验结果无效。取10毫升0.1摩尔/升的FeCl₃溶液到量筒中,并将其与10毫升0.1摩尔/升的KSCN一起倒入干净的烧杯中。由于形成了产物络合物分子[Fe(SCN)(H₂O)₅]²⁺(aq),出现了深红色。用50毫升蒸馏水稀释产物分子。现在将溶液倒入四个烧杯中并施加胁迫。
预防措施
进行实验需要采取一些预防步骤,如下所述:
使用的试管应具有精确的直径。
此实验室实验需要稀释的硫氰酸根溶液来进行实验。
比较是根据实验过程中观察到的颜色的强度进行的。反应完成后出现的颜色被认为是实验的参考颜色。
观察结果
观察表列举如下:
| 试管 | 在平衡状态下添加的物质 | 颜色变化 | 对[Fe(SCN)(H₂O)₅]²⁺浓度的影响 | 在平衡状态下观察到的变化 |
|---|---|---|---|---|
| A | 5毫升水 | 参考颜色 | 不适用 | 不适用 |
| B | 5毫升0.1摩尔/升FeCl₃溶液 | 颜色趋于加深 | 增加 | 向右移动 |
| C | 5毫升0.1摩尔/升KSCN溶液 | 颜色趋于加深 | 增加 | 向右移动 |
| D | 5毫升0.1摩尔/升KCl溶液 | 颜色变浅 | 增加 | 向左移动 |
表1 - 在各种条件下平衡状态的变化
结论
在本教程中,重点介绍了实验室实验,解释了给定反应的平衡状态可能发生的变化。然而,勒夏特列原理指出,如果引入胁迫,则会发生平衡态的变化。借助该原理解释了实验分析。
常见问题
1. 为什么平衡实验只能用稀溶液进行?
平衡实验只能用稀溶液进行的原因是,为了便于处理和理解在反应中产生各种胁迫时的颜色变化。此外,浓溶液由于在施加胁迫时会产生大量的热,可能会对实验室造成严重的损害。
2. 为什么平衡实验中要使用相同尺寸的沸腾管?
沸腾管是尺寸较小的圆柱形容器,用于在实验室条件下用本生灯火焰强烈加热物质。在平衡实验中使用相同尺寸的沸腾管的原因是为了获得要添加的溶液的精确测量值,以便参考。
3. 平衡常数与速率常数有何不同?
平衡常数与反应物的初始浓度无关,而速率常数取决于温度等方面。


 数据结构
数据结构 网络
网络 关系型数据库管理系统 (RDBMS)
关系型数据库管理系统 (RDBMS) 操作系统
操作系统 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C语言编程
C语言编程 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP