非均相平衡
简介
非均相平衡是指所有反应物和产物都处于不同相的化学平衡。均相平衡是指所有反应物和产物都处于同一相的平衡。
化学平衡定义为正向反应和逆向反应发生的速度相等。根据反应物和产物的相态,平衡分为两种类型:均相平衡和非均相平衡。当平衡过程中反应物和产物结合形成单一相(无论是气相还是液相)时,称为均相平衡。在这种情况下,反应物和产物的浓度可能差异很大。另一方面,如果体系中反应物、产物或两者都存在于多个相中,则称为非均相平衡,例如气体与固体或液体反应的情况。
什么是化学平衡?
1803年,Berthollet 发现一些化学反应是可逆的,这导致了化学平衡的概念。任何反应混合物必须具有相等的正向和逆向反应速率才能处于平衡状态。要达到化学平衡,正向反应和逆向反应的速率必须相等。
如果一个化学过程处于平衡状态,则反应物和产物的浓度稳定或不再随时间变化。化学平衡分为均相平衡和非均相平衡两种,这取决于平衡时反应物和产物的状态。“homo”和“hetero”前缀分别源于希腊语中“相似”和“不同”的意思。
什么是非均相平衡?
顾名思义,非均相平衡是指反应物和产物至少存在于两种不同物质状态中的平衡。例如,冰水平衡体系中的平衡反应表示如下:
$$\mathrm{H_2 O_{(S)} \leftrightarrow H_2 O_{(l)}}$$
因此,在上式中,反应物和产物的状态不同。体系中存在两种类型的物质:液体和固体。由于平衡体系中反应物和产物的状态或相态不同,因此被称为非均相平衡体系。碳酸钙分解成氧化钙和二氧化碳就是一个非均相平衡的例子。
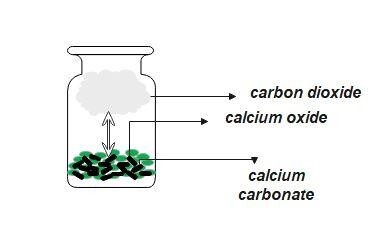
由于反应物和产物存在于不同的相中,非均相平衡的平衡常数表达式与均相平衡的表达式不同。当反应物和产物以纯液体或固体相存在于平衡时,它们的浓度不计入计算。
非均相平衡的例子
以下是一些在非均相平衡下发生的典型化学反应示例。
溴在室温下自然以液态存在。它很容易变成蒸汽,在两个阶段都是红色的。在平衡状态下,**溴蒸汽**的凝结和蒸发速率相同。方程式如下:
$$\mathrm{Br_{2(l)} \leftrightarrow Br_{2(g)}}$$
这是一个非均相平衡体系,因为溴作为反应物和产物都存在于多个相中,并且体系处于平衡状态。
另一个非均相平衡体系的例子是碳和**二氧化碳**之间的反应。当**固体碳**和气态二氧化碳混合时,会产生气态**一氧化碳**。在这个平衡过程中,正向反应和逆向反应的速率相同。方程式如下:
$$\mathrm{CO_{2(g)} + C_{(s)} \rightarrow 2CO_{(g)}}$$
您可以观察到,由于反应物和产物都以固态或气态存在,上述平衡反应是非均相的。
另一个非均相平衡的例子是**氯气**和**PCl3**在平衡状态下的反应。因为在这个平衡体系中,氯气以气态参与反应,并以固态形成**五氯化磷**,三氯化磷以液态存在。方程式如下:
$$\mathrm{PCl_{3(l)} + Cl_{2(g)} \leftrightarrow PCl_{5(s)}}$$
**水蒸气**与高温**碳**的反应是另一个非均相平衡的突出例子。方程式如下:
$$\mathrm{H_2 O_{(g)}+ C_{(s)} \leftrightarrow H_{2(g)} + CO_{(g)}}$$
如您所见,上述反应处于平衡状态,其中红热的碳处于固相,**水蒸气、一氧化碳**和氢气处于气相。因此,它是一个非均相平衡的例子。
非均相平衡反应的平衡常数
平衡常数表示平衡时产物与反应物之间的关系。用KC表示。在KC中,C代表浓度,因为反应物和产物的浓度用于推导平衡常数。例如,请看下面给出的典型反应:
$$\mathrm{aA + bB ↔ cC + dD}$$
$$\mathrm{K_{C} = \frac{[C]^c [D]^d}{[A]^{a}[B]^b}}$$
在非均相平衡中,不包括固体、纯液体和溶剂的浓度,因为它们不随温度而显著变化,因此被视为单位或1。在制定非均相平衡反应的平衡常数时,这一点很重要。下面给出一些例子:
溴的反应(平衡)
$$\mathrm{Br_{2(l)} \leftrightarrow Br_{2(g)}}$$
$$\mathrm{K_C =[Br_2]}$$
碳和二氧化碳的反应
$$\mathrm{CO_{2(g)} + C_{(s)} → 2CO_{(g)}}$$
$$\mathrm{K_C= \frac{[CO]^2}{[CO_2]}}$$
均相平衡反应
如果反应的所有反应物和产物都处于相同的相或物质状态,则该反应被称为“均相平衡反应”或“均相平衡”。考虑一下一氧化碳和氢气的反应。方程式如下:
$$\mathrm{CO_{(g)}+ 2H_{2(g)} \leftrightarrow CH_3 OH_{(g)}}$$
因为一氧化碳、氢气和甲醇都以气态存在于反应中,并且反应处于平衡状态,所以它被称为均相平衡。
结论
非均相平衡定义为来自不同相的反应物和产物之间的平衡。相反,在均相平衡中,反应物和产物处于同一相。计算平衡常数将允许您确定反应速率,而不管平衡如何。非均相平衡的例子包括碳酸钙分解成氧化钙和二氧化碳,而均相平衡的例子包括一氧化碳与氢气反应生成甲醇。
常见问题
1. 非均相平衡和均相平衡的区别是什么?
如果所有反应物和产物都处于同一相,则为均相平衡;如果反应物和产物处于不同相,则为非均相平衡。
2. 碳酸钙的分解是均相平衡反应吗?
是的,因为碳酸钙处于固态,而产物处于固态和气态。因此它是非均相体系。反应如下:
$$\mathrm{CaCO_{3(s)} \leftrightarrow CaO_{(s)} + CO_{2(g)}}$$
3. 影响化学平衡的因素有哪些?
平衡受体系的温度、压力和浓度的影响。
4. 谁发现了化学平衡?
化学平衡理论是由 F. H. van't Hoff 提出的(1884-1886)。
5. 化学平衡理论是什么?
当正向反应和逆向反应的速率相等时,就达到了化学平衡。这就是化学平衡理论。


 数据结构
数据结构 网络
网络 关系数据库管理系统 (RDBMS)
关系数据库管理系统 (RDBMS) 操作系统
操作系统 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C语言编程
C语言编程 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP