乙炔的结构
引言
乙炔的结构是帮助理解乙炔组成重要性的最重要属性之一。“量子力学理论”有助于展示乙炔的结构组成。原子内部形成三键,这种键被认为是所有键中最强的键。乙炔的结构是“不饱和烃”,其中存在最小范围的碳三键。三键的生成基于两个原子的能力。
什么是乙炔?
纯乙烯本质上极不稳定,它由两个独立的碳原子组成。这两个键彼此“三键”结合。埃德蒙·戴维于 1836 年首先发现了这种成分。1860 年,法国艺术家马塞林·贝特洛重新发现了这种成分,然后最终将其命名为乙炔。乙炔的整个化合物表明它包含氢原子和碳原子。一个σ键的存在使该成分成为碱性族中最强的化合物之一。
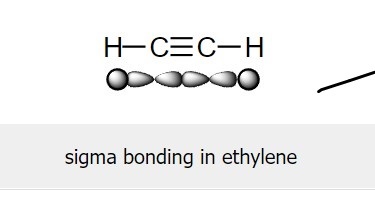
甲烷在部分燃烧方面的作用很重要,因为它有助于制备乙炔。“碳化钙的水解”是乙烯的来源。乙炔化钙的化学式为 CaC2。水和碳化钙之间存在化学反应。该反应的表示如下。
$$\mathrm{"H_{2}O\:+\:CaC_{2}\:\rightarrow\:C_{2}H_{2}\:+\:Ca(OH)_{2}"}$$
此反应表明,氢氧化钙和乙烯作为最终产物产生。“碳碳三键”的存在使乙炔成为“不饱和烃”。
三键的定义
三键与大多数炔烃中存在的碳碳键紧密相关。通常在两个特定原子内共享三对独立电子。这导致三键的生成。
此特性将碱性物质与其他成分区分开来,因为三键存在于碳原子中。三键中的碳原子被发现是杂化的。“两个杂化的 sp 轨道”的正面重叠与该键的形成和结构组成有关。
乙炔的结构
乙炔的俗名是乙炔。乙炔是一种重要的烃类,通常以气态形式出现。这种形式呈无色,通常用于许多化合物的许多组成部分。
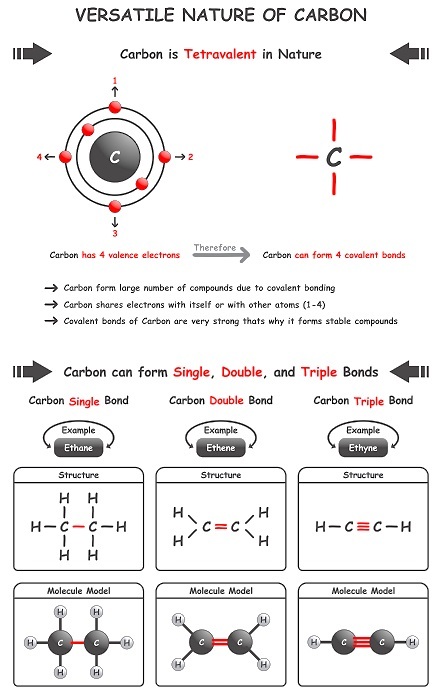
乙炔的结构组成使其无法以纯净形式使用。该结构表明乙炔存在稳定性问题。某些商业产品的制备包括该成分的积极参与。该键的存在使该烷烃成为“不饱和炔烃”。基于这种结构表示,该碱的式被开发为 C2H2,它被广泛称为乙炔。成为烃的原因是该成分的组成,即氢原子和碳原子。
乙炔的性质
对乙炔结构的理解取决于其重要的性质。
物理性质如下。
该成分的分子量为“26.038 g/mol”。
沸点为“-84.7°”。
熔点为“-80.8°C”。
密度值为“1.97 kg/m3”。
乙炔的所有特定化学性质如下。
该成分的化合物处于一定范围的π电子。
在乙炔的 C-C 三键中,这些电子有助于产生反应。
酒精、乙烯基化合物、丙烯酸和乙炔化物等商业产品与乙炔的化学成分紧密相关。
通常使用乙炔的化学属性获得有机金属化合物。
乙炔的应用
乙酰基的结构成分及其三键有助于该产品在不同领域得到应用。一些最重要的应用如下。
焊接过程包括乙炔的积极应用。非常高的温度(约 3300°C)是其广泛应用的主要原因。
乙炔是燃料的重要组成部分之一。
炸药也是使用乙炔制备的。
便携式灯具中含有乙炔。
“丙烯酸衍生物”的制备包括使用乙炔。
使用该成分制造塑料。
乙炔被用作“第一个天然半导体”,因此被广泛用于生产聚乙炔。
钎焊过程包括乙炔的积极使用。
玻璃工业也使用这种成分,因为它有助于制造合成橡胶。
乙炔最重要的应用在于焊接金属和保鲜食品。
结论
乙炔是一种重要的线性分子,其“碳碳距离约为 1.21 A°”。s 轨道的重叠是乙炔结构生成的主要原因。每个原子都拥有三个不同的 p 轨道。乙炔的 C-H 距离记录为 1.08。较短范围的烯烃与碳的杂化有关。由于乙炔的有益特性,其在不同工业用途中的应用日益增加。
常见问题
1. 乙炔的结构中有多少个三键?
乙炔是最简单的烃。它具有三个不同的σ键。其中两个键位于氢和碳之间,最后一个键位于“两个碳原子”之间。
2. 过量使用乙炔的两个最重要副作用是什么?
直接接触乙炔会导致严重的头部疼痛。空气中过量的乙炔会导致人突然窒息,甚至面临迫在眉睫的死亡。
3. 乙炔成为亲核试剂的原因是什么?
由于乙炔的反应活性,它是一种重要的亲核试剂。许多反应与之相关,这有助于生产一些商业产品,如酒精、乙炔化物和丙烯酸。


 数据结构
数据结构 网络
网络 关系数据库管理系统 (RDBMS)
关系数据库管理系统 (RDBMS) 操作系统
操作系统 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C语言编程
C语言编程 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP