什么是未饱和溶液?
简介
未饱和溶液需要溶质分子更多地溶解到溶液中。 能够分解溶质的不同类型的溶剂显示出与其原始溶剂明显不同的物理特性。 一旦溶质的所有特性都被溶剂吸收,两种不同成分就会呈现出共同的相似之处。
饱和溶液的类型
溶液的类型如下:
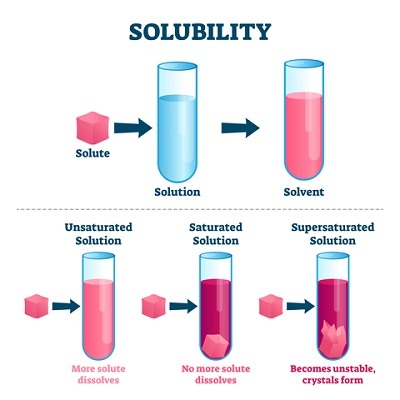
图1:饱和溶液的类型
未饱和溶液
未饱和溶液是指溶剂可以溶解更多浓度的溶质颗粒。 它也表明溶液尚未达到饱和点。
饱和溶液
溶剂在其分子间距离内吸收最大量溶质颗粒的溶液称为饱和溶液。 在这种情况下,一杯水在室温下最多能溶解10克糖。 因此,该溶液可以被认为是糖水的饱和溶液。 因为水分子之间没有更多空间容纳单个糖单元。
过饱和溶液
过饱和溶液是一种超过饱和水平的溶液。 例如,一杯水最多溶解10克糖,即使再加入10克糖也会导致溶液过饱和。 因为水分子之间没有更多空间容纳糖分子,导致多余的糖分子沉淀在杯底。
未饱和溶液的制备
溶剂可以是固态、液态或气态,能够溶解任何固态、液态或气态颗粒作为溶质。 溶液包含少量溶质的物理性质以及一些纯溶剂的性质。
对于均相溶液,溶剂和溶质处于相同的物质状态,因此溶液的物理性质与其纯态的性质没有变化。 例如,用糖、盐和水制成的清凉饮料;其中存在一种溶剂和两种溶质。 这两种溶质是均质的,一旦这两种溶质混合到一杯水中,它们的物理形状就不会保留。

图2:过饱和溶液的制备
Cuterjeans,过饱和溶液,CC BY-SA 4.0
过饱和溶液的制备是一个非常简单的过程,可以确定特定溶液的最大饱和限度。 因此,制备未饱和溶液的过程被认为是一个溶剂限制过程,其中溶剂充当溶质量的限制剂。 例如,如果一杯水能够溶解10克糖,那么只倒入2克糖。 溶质最终不会溶解,这意味着饱和过程仍然完成。 这定义了溶剂不能溶解更多溶质并达到其过饱和点。
改变未饱和溶液的步骤
改变未饱和溶液的步骤分为三种分类。 第一步是向溶剂中添加更多溶质,以帮助其达到饱和点。 在这种情况下,必须将溶质倒入溶剂中并搅拌,直到溶质不再溶解。 第二种方法是加热饱和溶液。
通过失去溶剂的属性,饱和溶液会变成过饱和状态。 糖水溶液在沸腾时会将水汽化。 因此,水的体积减少,但溶质的量保持不变。 因此,未饱和溶液一段时间后会变成过饱和溶液。
未饱和溶液的性质
未饱和溶液的性质如下:
未饱和溶液很容易受到不同类型溶质添加的影响。
它能够吸收更多量的溶质颗粒,因为其溶剂部分仍然在溶剂分子之间的分子间空间中留有空位。
在密闭条件下加热饱和溶液会导致溶剂分子之间的分子间空间增大,并且可以溶解更多量的溶质分子。 因此,通过在密闭条件下加热饱和溶液可以将其转化为未饱和溶液。
这些是一些未饱和溶液的特性。
饱和溶液和未饱和溶液的区别
| 饱和溶液 | 未饱和溶液 |
|---|---|
| 当饱和溶液的温度升高时,它会转化为未饱和溶液,需要更多量的溶质才能恢复到饱和点。 | 当未饱和溶液被加热时,除非需要更多量的溶质颗粒才能达到饱和点,否则不会发生显着变化。 |
| 当温度开始下降时,溶液的饱和点开始下降,在较低的温度下,它会变成过饱和溶液,溶液底部有多余的溶质颗粒。 | 当温度下降到某个点以下时,不饱和点会降低,溶液很容易达到饱和点。 |
| 溶质的沉淀是可见的,因为溶剂没有更多空间溶解溶质颗粒。 | 溶剂中留有大量空间来溶解溶质。 因此,这是一个零沉淀的情况。 |
表1:饱和溶液和未饱和溶液的区别
结论
本教程解释了日常活动中饱和溶液的含义。 学习者能够理解溶液如何变得不饱和。 有些步骤能够讨论改变未饱和溶液状态的基本方法。 通过改变影响饱和水平的因素来获得该过程。
常见问题
Q1. 影响溶剂溶解度的因素有哪些?
答:已知影响溶质溶解度的两个主要因素是溶液的温度和压力。
Q2. 微溶液体是什么意思?
答:由于溶质和溶剂的各种物理性质,这种类型的液体无法利用分子间空间完全溶解溶质颗粒。 因此,溶质部分溶解,大量溶质无法溶解到溶剂中。
Q3. 极性溶质在什么状态下能够溶解?
答:溶剂的极性有助于利用极性分子或离子相互作用溶解极性溶质。 大多数可溶性溶质都处于这种状态,在这种状态下,同化过程很可能会发生。


 数据结构
数据结构 网络
网络 关系数据库管理系统 (RDBMS)
关系数据库管理系统 (RDBMS) 操作系统
操作系统 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C语言编程
C语言编程 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP