方位角量子数 - 定义、辅助内容和常见问题
引言
方位角量子数及其研究对于理解物质的量子特性至关重要。原子是物质的基本单元。根据玻尔原子模型,原子包含一个小的中心核心,称为原子核,充满正电荷。电子围绕原子核在特定圆圈(称为轨道)中旋转。圆周路径由电子和原子核之间静电力产生的向心力维持。不同的轨道具有不同的能量。由于它无法解释海森堡不确定性原理和粒子的波粒二象性,因此形成了一个新的分支,称为量子力学。它是由埃尔温·薛定谔发展起来的。他根据像电子这样的粒子的波动性发展了这一点。量子力学的主要概念是能量的量子化、粒子的波粒二象性和不确定性原理。
什么是量子数?
量子数用于确定电子的位置。它描述了原子的能级。不同的轨道具有不同的尺寸、形状和方向。量子数代表原子的轨道的不同特性。这意味着量子数提供了关于电子大小、形状、位置和空间方向的完整信息。有四个量子数来解释电子的状态。它们是
主量子数 (n)。
磁量子数 (ml)。
方位角量子数 (l)。
自旋量子数 (ms)。
什么是主量子数?
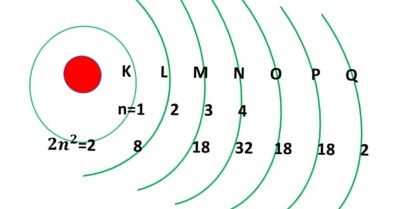
这个数字提供了关于电子能级轨道的信息。主量子数表示电子离原子核的距离。它用符号 n 表示。它取从 1 到无限大的正整数(即)n=1,2,3……
根据 n 的值,电子层分别用K、L、M、N、O等表示。
每个轨道的电子占据数由$\mathrm{2n^2}$定义。
如果 n=1,则 K 轨道有两个电子。
如果 n=2,则 L 轨道有 8 个电子,依此类推。
如果电子从较低的能级跃迁到较高的能级,则 n 值增加,这称为吸收。如果电子从较高能级跃迁到较低能级,则 n 值减小,这称为发射。在吸收过程中,电子吸收能量;在发射过程中,电子释放能量。
主量子数还给出了一个方程,用于计算氢原子的能量,如下所示:
$$\mathrm{En =-\frac{2\pi^2 me^4 Z^2}{n^2 h^2}}$$
从 K 到 Q,轨道的能量值逐渐增加。
定义:方位角量子数
这个数字通过确定轨道的轨道角动量来提供关于轨道构型的信息。在多电子原子中,电子的能量路径不同,因此它们的角动量也不同(即)多电子原子中存在亚层。这个数字用l表示。方位角量子数由主量子数决定。它提供了关于亚层的形状、能量和角动量的详细信息。方位角量子数l的值为 0 到 (n-1)。
它们用s、p、d、f……表示。

让我们取 n=1,它是 K 层。
方位角值为 l=0。它只有一个亚层。它是 1s。
如果 n=2,它是 L 层。
方位角值为 l=0,1。它有两个亚层。它们是 2s、2p。
如果 n=3,它是 M 层。
方位角值为 l=0,1,2。它有三个亚层。它们是 3s、3p、3d。
| 主量子数(n) | 电子层 | 方位角量子数(l) | 亚层数 | 亚层 |
|---|---|---|---|---|
| 1 | K | 0 | 1 | 1s |
| 2 | L | 0,1 | 2 | 2s, 2p |
| 3 | M | 0,1,2 | 3 | 3s, 3p, 3d |
| 4 | N | 0,1,2,3 | 4 | 4s, 4p, 4d, 4f |
表 1:主量子数和方位角量子数的填充
因此,亚层数和主量子数相同。
方位角量子数的历史
玻尔利用量子化的概念并提出了他的理论。根据他的理论,电子绕原子核旋转而不损失能量。当电子从较低的能级跃迁到较高的能级时,它会获得能量;当电子从较高的能级跃迁到较低的能级时,它会损失能量。他用量子数 n=1,2,3……表示能级,如 K、L、M 等。但这无法解释原子的电场和磁场效应,而且他的概念只适用于较小的原子。它也无法解释电子的附加行为。除了主量子数之外,还增加了三个量子数来描述多电子原子的行为。
方位角量子数是从玻尔原子模型中沿用过来的。最低能级具有零角动量。也就是说,它被认为是一维的。在三维空间中,它像摆一样在圆形路径上振荡。
结论
原子由中心处的原子核组成,周围环绕着电子。量子数用于数值确定电子的位置。所有四个量子数都提供了关于电子的形状、大小和方向的信息。这里讨论了主量子数和方位角量子数。
常见问题
Q1. 什么是泡利不相容原理?
答:泡利不相容原理是量子力学的理论。根据该理论,没有两个费米子可以处于相同的态。对于电子而言,两个电子不能处于相同的量子态。
如果粒子服从这个原理,则被称为费米子。例如:电子、原子、中子。
如果粒子不服从这个原理,则被称为玻色子。例如:光子。
Q2. 说明洪特规则。
答:该规则解释了电子在轨道中的分布。它指出,首先,轨道的每个亚轨道都被单个电子占据。之后,才会发生电子的配对。
Q3. 量子数的重要性是什么?
答:量子数描述了电子在空间中的位置。根据四个量子数的薛定谔波动方程,提供了关于电子特性的完整信息。根据泡利不相容原理,两个电子不能处于四个量子能级。这些量子数描述了原子的能级、亚层和电子的方向。自旋量子数表示电子的自旋方向。
Q4. 什么是海森堡不确定性原理?
答:海森堡不确定性原理描述了不可能同时找到电子的位置和动量。
Q5. 什么是原子轨道?
答:表示电子位置及其波动性的数学量被称为原子轨道。


 数据结构
数据结构 网络
网络 关系数据库管理系统 (RDBMS)
关系数据库管理系统 (RDBMS) 操作系统
操作系统 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C语言编程
C语言编程 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP