键参数
引言
多种因素被用于评估共价键。键长、键强度、键极性和键多重性只是其中一部分。让我们看看这些特性意味着什么以及它们如何影响我们。让我们从键长开始。
键长
键长定义为分子中两个成键原子核之间的平衡距离。键长由键合对中的每个原子决定。键合对中的每个原子都参与共价键的键长。每个原子的贡献被称为该原子的共价半径。在成键状态下,共价半径计算为与相邻原子核接触的原子核的半径。
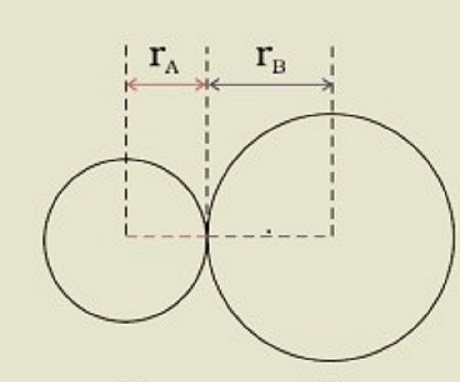
在共价分子 AB 中,键长的公式为 $\mathrm{R=r_A+r_B}$,其中 r_A 和 r_B 是两个原子的共价半径,R 是键长。共价半径定义为通过共价键连接的相同分子中两个相同原子之间距离的一半。在非键合状态下,范德华半径表示原子的整个大小,包括其价层电子壳层。
此外,在固体中,范德华半径是两个不同分子中相同原子之间距离的一半。共价半径总是大于范德华半径。
影响键长的因素包括:
由于随着电子的增加,价层电子与原子核之间的距离增加,因此键长随着原子大小的增加而增加。
例如:
$$\mathrm{C-C\:\lt\:Si-Si\:\lt\:Ge-Ge}$$
随着键多重性的增加,键长减小。
$$\mathrm{O=O\:\lt\:O-O}$$
键角
键角定义为在配合物或分子离子中围绕中心原子的具有成键电子对的轨道之间的角度。键角以度/分/秒为单位测量,可以使用光谱技术通过实验获得。它通过让我们了解中心原子周围轨道的排列,帮助我们确定分子/配合物离子的形状。
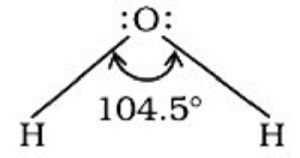
例如,在水中,H–O–H 键角可以表示为:
键级
在共价键的路易斯理论中,键级决定了分子中两个原子之间的键的数目。
例如,考虑 H2,它有一个共享电子对,O2 有两个共享电子对,N2 有三个共享电子对,则键级分别为 1、2 和 3。在 CO 中,C 和 O 之间有三个共享电子对,键级也是 3。
等电子分子和离子的键级相等;例如,F2 和 $\mathrm{O_2^{2−}}$ 的键级为 1。N2、CO 和 NO+ 的键级为 3。
键级增加,键焓增加,但键长减少。这对于理解化合物的稳定性非常重要。
键焓
键焓是指断裂一摩尔气态特定类型原子间的键所需的能量。键焓以 kJ mol–1 为单位测量。例如,氢分子中 H–H 键的焓为 435.8 kJ mol–1。
$$\mathrm{H_2(g)\:\rightarrow\:2H(g) \:\:\:\:\:\:\:\Delta H^{\circ}=435.8\:kJ\: mol^{-1}}$$
$$\mathrm{N_2(g)\:\rightarrow\:2N(g)\:\:\:\:\:\:\:\Delta H^{\circ}=498\:kJ\:mol^{−1}}$$
$$\mathrm{O_2(g)\:\rightarrow\:2O(g)\:\:\:\:\:\:\:\Delta H^{\circ}=946\:kJ\:mol^{−1}}$$
影响键焓的两个因素总结如下:
键长
键焓值越大,键长越短。C-C 键长为 154 pm,长于 C=C 键长 134 pm。因此,C-C 键的键解离焓为 433 kJ/mol,而 C=C 键的键解离焓为 619 kJ/mol。
原子大小
键越强,成键原子越小。因此,键解离焓必须具有较高的值。例如,H-H 键的键解离焓为 435.8 kJ/mol,高于 Cl-Cl 键的 243.5 kJ/mol。
键解离焓越大,分子中的键就越强。我们有一个像 HCl 这样的异核双原子分子。
$$\mathrm{HCl(g)\:\rightarrow\:H(g) + Cl(g) \:\:\:\:\:\:\Delta H^{\circ}=431.0\:kJ\:mol^{1}}$$
多原子化合物中键强度的测定更为困难。例如,断裂 H2O 分子中两个 O-H 键所需的焓并不相同。$\mathrm{\Delta H^{\circ}}$ 值的差异表明,第二个 O-H 键随着化学环境的变化而变化。
结论
当两个原子共享一对电子时形成单共价键,当共享两对或三对电子时形成多重键。一些成键原子具有未参与成键的额外电子对。
它们被称为孤对电子。路易斯点结构显示了分子中每个原子周围成键对和孤对的排列。键长、键角、键焓和键级都是与化学键相关的重要的因素,它们对化合物的性质有很大的影响。
常见问题
Q1. 提到一些影响化学键的键参数。
Ans. 影响化学键的键参数是
键长
键级
键角
键焓。
Q2. 为什么多重键比单键更强?
Ans. 随着两个原子之间成键电子的数量增加,它们之间的键长缩短,从而形成多重键。原子之间较高的电子密度导致它们之间更强的相互作用,从而导致键长减小。相互作用越强,键就越强。因此,多重键比单键更强。
Q3. 键长是什么意思?
Ans. 键长或键距是共价键合原子中心之间的距离。使用物质的 X 射线衍射、电子衍射和光谱(分析分子吸收/发射的光)技术来估计键长。
Q4. 原子的范德华半径是什么?
Ans. 在非键合状态下,范德华半径表示原子的整个大小,包括其价层电子壳层。此外,在固体中,范德华半径是两个不同分子中相同原子之间距离的一半。共价半径总是小于范德华半径。(原文此处有误,应为小于)
Q5. 周期表中单共价半径遵循什么趋势?
Ans. 已经观察到,单共价半径沿族向下增加,而沿周期从左到右减小。


 数据结构
数据结构 网络
网络 关系数据库管理系统 (RDBMS)
关系数据库管理系统 (RDBMS) 操作系统
操作系统 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C语言编程
C语言编程 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP