电导滴定法
简介
电导滴定法是一种利用电导仪进行化学反应的滴定方法。与其他滴定方法一样,需要使用指示剂来确定终点;在这里,使用电导仪来找到反应的终点。其原理是通过反应混合物中一个离子取代另一个离子。溶液中离子的这种交换有助于测量电导率的变化。这些变化有助于达到终点,从而表明反应已完成。这种利用电导仪确定终点的滴定方法称为电导滴定法。
什么是电导滴定法?
它是用于测定样品浓度的定性化学分析方法之一。
在这种滴定中,电解质电导率的增加或减少是由于反应混合物中离子浓度的变化引起的。
在这种滴定中,电导率的测量作为一种工具来寻找终点。
因此,这种滴定有助于利用电导率测量来确定滴定的终点,称为**电导滴定法**。
电导滴定法中使用的术语
使用的术语如下:
**滴定剂** - 指浓度已知的溶液。它是一种标准溶液,添加到浓度未知的另一种溶液中。
**分析物** - 指浓度未知的溶液。
**终点或等当点** - 指滴定过程中电导率发生突然变化的点。换句话说,将必要的反应物添加到溶液中以**完成反应**。
**电导率 (G)** - 定义为电阻 (R) 的倒数。换句话说,电导率越高,电阻越小,电流越容易流动。
$$\mathrm{G=\frac{1}{R}}$$
原理
电导滴定法的原理是:
“一个离子被另一个离子交换,这些离子的离子电导率差异直接影响溶液的总电解质电导率。”
此外,它是一个体积过程,依赖于滴定过程中反应混合物或样品**“电导率”**的测量。滴定中发生的电导率可以用欧姆定律来解释,欧姆定律指出,流过导体的电流 (i) 与电位差 (V) 成正比,与电阻 (R) 成反比。
$$\mathrm{i=\frac{V}{R}}$$
其中 V= 电位差
i= 电流
R= 电阻
因此,以上所有因素 V、i 和 R 都取决于:
离子的迁移率。
自由离子的数量和电荷(正或负)。
温度。
理论
在这种类型的滴定中,终点通常通过电解质电导率来测量。例如,当我们进行酸碱滴定(中和反应)时。最初,溶液的电导率降低。然后,溶液的电导率会突然增加。这种电导率的增加或减少是由于反应混合物在反应前后离子差异造成的。这种差异有助于产生终点。为了计算这种反应的终点,绘制了一个图表。以下是所示图表:
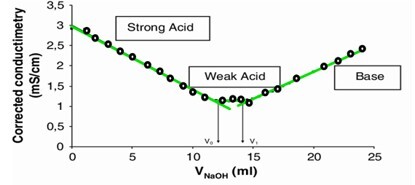
解释
此图基于酸碱滴定,当 NaOH(滴定剂)不断添加到酸溶液中时,它用碱的阳离子部分取代 H^+ 离子。从而使酸溶液中的 H^+ 离子持续减少,这也降低了电导率。当所有离子都被交换并且只有滴定剂离子(OH^-)可用于导电时,就会达到一个点。滴定剂离子浓度的增加会增加电导率。电导率的突然变化有助于确定终点。当在**电导率与滴定剂体积**的图中绘制观察到的电导率和滴定剂值时,它将给出两条具有相反斜率的直线。这两条线进一步在一个称为终点的点处相交。
过程
为了进行这种滴定,需要遵循以下步骤:
收集所有设备,例如滴定管、滴定管架、烧杯和连接到电导仪的电导池。
首先,用碱充满滴定管并记录其初始体积。
然后,制备分析物,例如用蒸馏水稀释的酸。
现在,将电导池(应正确浸入)插入此分析物或稀释的酸溶液中。然后将此池连接到电导仪并准备好记录读数。
现在,将碱逐滴添加到分析物或酸溶液中。
必须记录电导率的变化以及碱的记录。它显示出电导率最初降低。
添加更多几滴后,它显示出反应混合物或溶液的电导率突然增加,因为离子浓度增加。
最好再进行一些读数以找到正确的终点。
最后,绘制观察值的图形。此绘制的图形有助于从两条线的交点找到等当点或终点。
电导滴定法的优缺点
一些优点是:
它不需要任何指示剂,因为电导率的变化由电导仪测量。
它适用于各种类型,例如有色溶液、稀溶液和浑浊溶液。
其终点是通过图形获得的,因此它可以获得更好的结果,误差最小。
它没有温度问题,因为它在整个滴定过程中保持恒定。
一些缺点是:
它不能保证提供 100% 的准确性,因为该过程不允许添加少量滴定剂的增加。
由于滴定过程中形成的沉淀物的缓慢分离以及离子在沉淀物上的吸附,因此它在沉淀反应中表现不佳。
它也仅限于氧化还原反应,因为溶液中高浓度的水合氢离子 (H_3 O+) 往往会掩盖电导率的变化。
电导滴定法的应用有哪些?
电导滴定法的各种应用有:
用于检查湖泊和河流中的水污染。
用于追踪食物中的微生物。
用于估算糖汁中的灰分含量。
用于确定水的纯度和水的去离子化。
用于检测水中氘离子浓度。
用于追踪抗生素。
结论
电导滴定法是一种利用称为电导仪的设备来确定物质浓度的滴定方法。该设备包含一个电导池,该电导池应该插入溶液(未知强度或浓度)中。它测量溶液中离子浓度的变化。离子浓度的差异显示出电导率的增加或减少。电导仪记录这些电导率的总体变化。因此,然后将这些记录的值绘制在图表上,这有助于确定终点或等当点。滴定中的此终点表示反应的完成。
常见问题
1. 电导法中使用哪种电极?
电导法中使用的电极是电导池,由石英或派热克斯玻璃制成。它由两个铂制成的电极组成,必须放在水容器中以保持其恒温。
2. 为什么电导法不用直流电?
如果使用直流电,会导致电解并随时间推移改变溶液的浓度。因此,最好使用交流电而不是直流电。
3. 在电导滴定中,电导率何时降低?
在酸碱滴定中,碱用其阳离子部分取代酸溶液的 H+ 离子,从而降低 H+ 离子的浓度。这种浓度的降低降低了溶液的电导率。
4. pH 值是否会影响电导滴定中的电导率?
pH 值通过氢离子浓度决定物质的酸碱性,而电导率则取决于自由电子的存在。pH 值和电导率之间没有关系。
5. 为什么电导池用于电导滴定?
电导池连接到电导仪,浸入溶液中,有助于测量反应混合物中离子浓度的连续变化。因此,可以获得各种有助于确定反应终点的数据。


 数据结构
数据结构 网络
网络 关系型数据库管理系统
关系型数据库管理系统 操作系统
操作系统 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C 语言编程
C 语言编程 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP