滴定类型
简介
滴定是一种用于化学中的定量分析方法,用于通过使用已知浓度的溶液(在指示剂存在下)分析给定未知化学溶液来确定其强度或浓度。
氧化和还原同时发生。滴定是通过其他溶液计算一种未知溶液浓度的过程。需要指示剂来检测等当点。它通常伴随着颜色变化。
什么是滴定?
当某些化学物质相互接触时,会发生离子交换的化学反应。滴定是一种用于化学中的定量分析方法,用于通过使用已知浓度的溶液(在指示剂存在下)分析给定未知化学溶液来确定其强度或浓度。参与滴定过程的已知浓度称为滴定剂。被滴定物质表示需要计算其量的物质。
需要通过校准的滴定剂浓度添加未知的分析物浓度”以识别作为分析一部分的滴定终点。在终点时,分析物和滴定剂的摩尔数将相同。滴定有助于不同浓度的容量分析。
滴定类型
滴定提供溶液的容量分析。它启动在适当溶剂中溶液浓度的估计体积。

图 1:滴定类型
体积估计过程或滴定可分为四种主要类型。它们是:络合滴定、沉淀滴定、氧化还原滴定和酸碱滴定。下面讨论不同的滴定过程。
酸和碱的滴定
酸碱滴定发生在碱和酸之间,其中一个为滴定剂,另一个为被滴定物。这两种浓度可以在终点相互中和,生成水和盐。方程式如下:
$$\mathrm{A^- + H^++ B^+ + OH^-\:\rightarrow\:A^- +B^+ +H^+ + OH^–}$$
酸碱滴定的等当点由pH指示剂或酸碱指示剂指示。
滴定步骤
用标准溶液、未知溶液和蒸馏水冲洗滴定管、移液管和锥形瓶。
分析物需要用移液管进行精确测量,然后送入装有少量指示剂的烧杯中。
滴定管应装满一半标准溶液。此外,需要记录测量的体积。
需要将估计量的已知溶液保持在这个水平。
从滴定管中排出溶液,使指示剂在某一点发生颜色变化,并记录该值。
这是初始滴定,相同的步骤重复三次,并记录平均值。
初始值和最终值的差表示使用的滴定剂总量。
指示剂的永久颜色变化表示达到终点。
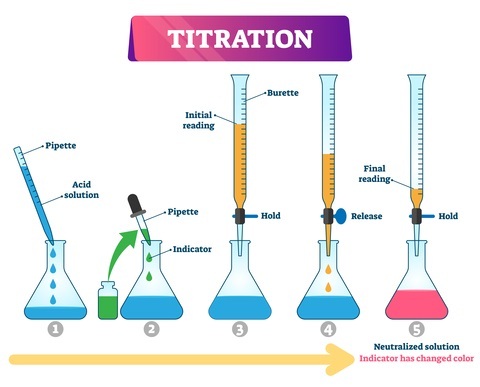
图 2:酸碱滴定步骤
指示剂本质上是弱碱性或弱酸性。将指示剂逐滴添加到溶液中进行此滴定过程,中和用尖锐的颜色变化表示。甲基橙和酚酞是两种最常用的酸碱指示剂。
氧化还原滴定
这种滴定也称为氧化还原反应。在该滴定过程的化学反应中,反应离子的水溶液接受电子。根据所用试剂,这种滴定可分为以下类型。
重铬酸盐滴定
在这种反应中,在酸性介质中使用重铬酸钾作为氧化剂。稀硫酸用于维持介质的酸性。反应为:
$$\mathrm{K_2Cr_2O_7+4H_2SO_4\:\rightarrow\:K_2SO_4+Cr_2(SO_4)_3+4H_2O+3[O]}$$
重铬酸钾溶液直接用于估算碘化物和亚铁盐。
高锰酸盐滴定
在这种滴定中,氧化剂是高锰酸钾。稀硫酸用于维持其性质。方程式为:
$$\mathrm{2KMnO_4+3H_2SO_4\:\rightarrow\:K_2SO_4+2MnSO_4+3H_2O+5[O]}$$
在达到终点之前,溶液没有颜色。可以使用标准化的高锰酸钾来估算亚铁盐、酸性酸、草酸盐和过氧化氢。
碘量法和碘量滴定法
在此过程中,游离碘被还原为碘离子,碘离子在释放电子后被氧化。表达式为:
$$\mathrm{l_2+2e^{−}\:\rightarrow\:2l^{−} }$$
$$\mathrm{2l^{−}\:\rightarrow\:I_2+2e^{−}}$$
在碘量滴定法中,使用游离碘作为指示剂以及反应的氧化剂,在碘量滴定法中生成游离碘。
络合滴定和沉淀滴定
沉淀滴定发生在两种反应物质接触并形成不溶性沉淀时。在氯化钠或硫氰酸铵溶液中,硝酸银溶液的使用在反应后会形成白色沉淀或氯化银或硫氰酸银。反应表示为:
$$\mathrm{AgNO_3+NaCl\:\rightarrow\:AgCl+NaNO_3}$$
在络合滴定中,在等当点会形成未解离的络合物。此过程中的共沉淀不会产生误差。它比沉淀滴定法更有用。络合滴定过程的表达式如下:
$$\mathrm{Hg^{2+}+2SCN^{−}\:\rightarrow\:Hg(SCN)_2}$$
一些金属络合物是在乙二胺四乙酸等有用试剂的帮助下形成的。
结论
滴定是测量一种物质在另一种物质存在下的量的过程。计算其量的物质称为被滴定物,而滴定剂以已知浓度存在。
根据反应参与物的类型,滴定可以分为不同的类型。它们是酸碱滴定、沉淀滴定、氧化还原滴定和络合滴定。酚酞、甲基橙和其他指示剂用于识别滴定过程的终点。
常见问题
Q1. 滴定中的指示剂是什么?
答:指示剂是弱酸和弱碱物质,它们在识别溶液中的化学变化时会改变颜色。它们指示其参与的溶液中pH值的改变。
Q2. 为什么滴定很重要?
答:滴定有助于了解溶液与其他酸性溶液的浓度量,并且可以重复利用这些溶液来准确确定浓度水平。
Q3. 滴定终点的含义是什么?
答:滴定终点是在滴定过程中将所需反应物完全添加到溶液中的时刻。它是滴定的终点。


 数据结构
数据结构 网络
网络 关系型数据库管理系统 (RDBMS)
关系型数据库管理系统 (RDBMS) 操作系统
操作系统 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C 编程
C 编程 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP