理想气体与真实气体的区别
引言
理想气体只是一种理论上的气体(只存在于理论中),因为实际上不可能存在理想气体。理想气体由大量随机(向任意方向)旋转的点状粒子组成,这些粒子之间不相互作用。理想气体(理论气体)的概念或思想之所以有用或重要,是因为它完全遵循理想气体定律(或理想气体方程)。真实气体是非理想气体,其分子占据一定空间,并相互作用,并且不遵循理想气体定律或理想气体方程。在常温常压下,冷空气表现为理想气体,但随着气体压力和温度的升高,由于气体分子之间的相互作用,它开始表现得像真实气体。
什么是理想气体?
理想气体只不过是一种理论上的气体,在现实或现实世界中并不存在。它由大量随机(向任意方向)运动的点状粒子组成,这些粒子之间不允许相互作用。但是,理想气体的概念或思想是必不可少的,因为它遵循理想气体定律:P(压力,单位为atm或bar)×V(体积,单位为l或mL)= n(给定的摩尔数)×R(气体常数)×T(温度)。在某些特殊情况下,例如完全弹性碰撞或点状碰撞,零相互作用(彼此碰撞)的基本要求通常可以放宽。尽管在各种情况下,例如温度(T)和压力(P)的变化,许多真实气体开始表现得像理想气体,其中气体分子充当理想粒子。通常,在较高温度和较低压力下,气体开始表现得像理想气体,因为由于分子间力(一种分子力)而产生的势能(U)与具有动能的粒子相比变得非常低或不那么重要。
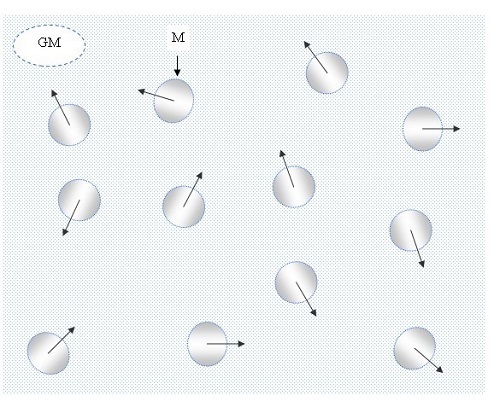
Василь Іванович Сидоров,分子动力学42. 理想气体模型,CC BY-SA 4.0
理想气体的性质
理想气体的一些性质或特征如下:
理想气体是可压缩的,因为分子包含如此多的能量,以至于它们迫使彼此向内移动,这就是我们所说的压缩。
在理想气体中,大多数与容器的碰撞都是弹性的,这意味着它们在碰撞后不会损失能量或能量为零,并继续运动。
理想气体能够由于其可压缩性而占据其所处的容器的形状。因此,容器的体积可以被认为是容器内存在的气体的总体积。
理想气体表现为惰性,这意味着它们被假定不会相互反应。
理想气体的粒子或分子是点质量,没有或体积为零。
什么是真实气体?
真实气体是非理想气体,其分子占据空间并相互作用。真实气体不遵循理想气体定律或理想气体方程。因此,真实气体通过考虑它们的摩尔质量或分子量和摩尔体积或分子体积来进一步设计、建模或表示。即$\mathrm{RT\:=\:(p\:+\:\frac{a}{v^{2}_{m}})(V_{m}\:-\:b)\:or\:,p\:=\:\frac{RT}{(V_{m}\:-\:b)}\:=\:\frac{a}{V_{m}^{2}}}$其中p=压力(单位为atm或bar),T=温度(大多以开尔文为单位),R=理想气体常数或气体常数,𝑉𝑚=摩尔体积。a和b是变化的变量,并根据经验为各个气体确定。当我们增加理想气体的压力或温度时,分子之间的相互作用变得非常快或迅速,无法使用气体定律计算或预测,因此被认为是真实气体。在这里,气体分子彼此之间发生非弹性碰撞。在真实气体中,分子或粒子之间存在吸引力或排斥力。
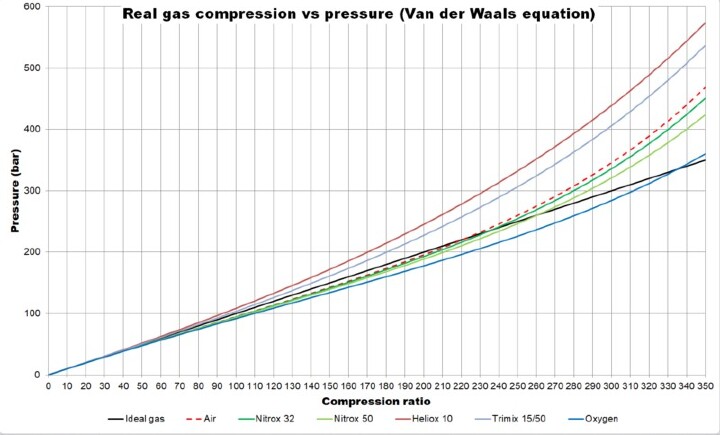
Pbsouthwood,真实气体压缩图(潜水呼吸气体),CC0 1.0
真实气体的性质
真实气体的一些性质或特征如下:
真实气体具有确定的体积。
在真实气体中,大多数与容器或彼此之间的碰撞是非弹性碰撞。
在真实气体中,分子之间存在分子间吸引力或排斥力。
这里,分子施加在放置它们的容器上的压力小于理想气体。
在真实气体中,气体分子可以自由地相互作用或碰撞。
真实气体不遵守理想气体方程,但它们遵守范德瓦尔斯真实气体方程,即$\mathrm{RT\:=\:(p\:+\:\frac{a}{v^{2}_{m}})(V_{m}\:-\:b)}$
理想气体与真实气体的区别
| 理想气体 | 真实气体 |
|---|---|
| 理想气体没有确定的体积,因为它占据其所处容器的形状。 | 真实气体占据确定的体积,因为它不占据容器的形状。 |
| 这里分子之间没有分子间力(无论是吸引力还是排斥力)。 | 这里存在分子间吸引力或排斥力。 |
| 这里的粒子发生弹性碰撞。 | 这里的粒子发生非弹性碰撞。 |
| 理想气体是一种理论概念,自然界中不存在。 | 真实气体在现实中存在。 |
| 这里的分子以非常高的压力随机移动。 | 这里的分子以比理想气体低的压力随机移动。 |
| 它遵循理想气体定律,即$\mathrm{PV\:=\:nRT}$。 | 它遵循范德瓦尔斯真实气体方程,即$\mathrm{RT\:=\:(p\:+\:\frac{a}{v^{2}_{m}})(V_{m}\:-\:b)}$ |
结论
理想气体只不过是一种理论上的气体(只存在于理论中),自然界中并不存在。这种气体遵循理想气体定律方程,即PV = nRT。在理想气体中,分子以非常高的压力向随机方向移动。这里存在的粒子发生弹性碰撞,并且不存在分子间力。真实气体是在自然界中存在的气体,它们也称为非理想气体,因为它们不遵循理想气体定律或理想气体方程。在真实气体中,分子以比理想气体低的压力向随机方向移动,并且这里的粒子可以相互作用并发生非弹性碰撞。
常见问题
1. 理想气体是什么意思?
理想气体是一种理论上的(非实际的)气体,它遵循或遵守理想气体定律,由PV = nRT给出。但在现实中,并不存在这种气体。它由大量随机(向任意方向)运动的点状粒子组成,这些粒子之间不允许相互作用。
2. 什么是非理想气体?
真实气体也称为非理想气体,它不遵循理想气体定律或理想气体方程。这种气体存在于自然界中,这里的分子发生非弹性碰撞,并且分子可以相互作用。
3. 写出范德瓦尔斯方程?
范德瓦尔斯气体方程由$\mathrm{RT\:=\:(p\:+\:\frac{a}{v^{2}_{m}})(V_{m}\:-\:b)}$给出,其中p或P=施加的压力,T=所需的温度,R=理想气体常数,𝑉𝑚=摩尔体积(气体占据的体积)。a和b是因气体而异的变量。
4. 什么是弹性碰撞?
弹性碰撞是一种发生在两个物体之间的碰撞,其中碰撞前后动能(K.E.)保持不变,或者能量(动能)没有净损失。
5. 哪个气体发生非弹性碰撞?
真实气体发生非弹性碰撞(碰撞前后动能不保持不变)。


 数据结构
数据结构 网络
网络 关系数据库管理系统 (RDBMS)
关系数据库管理系统 (RDBMS) 操作系统
操作系统 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C语言编程
C语言编程 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP