等温过程与绝热过程的区别
引言
到目前为止,我们已知的科学划分并不局限于物理学、化学和生物学。随着我们对这些领域的深入研究,我们越来越需要将我们的知识分类到这三大类(物理学、化学和生物学)下的各个分支学科。例如,有机化学处理的是碳基化合物及其性质。
热力学就是物理学的一个分支。虽然热力学领域非常广泛,但我们将尝试在此总结其定义,然后讨论两种主要的热力学过程,即等温过程和绝热过程。
什么是热力学?
《大英百科全书》将热力学定义为“研究功、热、能量和温度之间关系的科学”。这是对热力学最简洁的描述。
“热力学”一词本身是由希腊词“therme”(热)和“dynamis”(力)复合而成。因此,从词源学角度来说,热力学是研究热力学的科学。
在热力学中,我们研究功、温度和热量如何与能量和熵相关联。我们还研究物质和辐射的物理性质如何影响热量和温度。我们对热力学的所有了解都可以快速总结成一套四条规则,通常称为热力学定律。
热力学定律
热力学定律可以用多种形式表达。然而,它们都是普遍有效的,并且尚未发现对其含义的例外。有趣的是,这些定律中的第一个被称为“第零定律”,而不是“第一定律”。让我们详细讨论一下。
第零定律
第零定律阐述了热平衡的等价性,并提供了一种经验性的方法来定义温度是什么。根据第零定律,如果你取两个与第三个系统处于热力学稳定状态的系统,那么它们也必须彼此处于热平衡状态。该定律与数学中的等价表达式相同。如果 A=C 且 B=C,则 A=B。
第一定律
第一定律表达了系统内能与热量和功之间的关系。其数学表达式如下:
$\mathrm{\Delta U = Q-W}$
这里,ΔU 是系统的内能变化,Q 是获得的热能,W 是系统对其周围环境所做的功。
第二定律
第二定律确定了 100% 效率的不可能。它指出:
“在循环过程中,不可能将所有热能都转化为功。”
第二定律可用于预测某个过程是否允许发生。有时,某个过程遵循能量守恒定律,但由于它使第二定律失效,因此仍然是被禁止的。
第三定律
第三定律预测了系统在接近绝对零度时的行为。简单来说,它指出当系统的温度接近绝对零度时,所有过程都会停止,其熵开始趋于一个常数值,该值可以为零,也可以不为零。
什么是等温过程?
系统温度保持不变的过程称为等温过程。“等温”一词源于希腊词根“isos”(相等)和“therme”(热)。
然而,有趣的是,虽然我们说温度必须保持恒定,但并没有对系统进出热量的限制。
等温过程的例子
相变
等温过程最常见的例子之一是相变。当固体变成液体或液体变成蒸汽时,系统会获得热量。然而,熔化和蒸发是等温发生的。
卡诺发动机
卡诺发动机有多个阶段,其中两个阶段涉及等温过程。冰箱基于卡诺循环,因此它们也涉及等温阶段。

等温过程中所做的功的表达式
所做功的热力学表达式如下所示。
$\mathrm{W=\int\:P \cdot dV}$
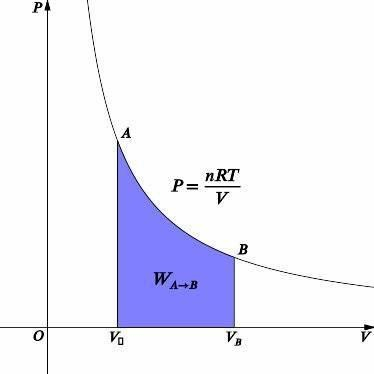
在等温过程中,我们知道温度是恒定的。等温过程的图表如上所示。使用理想气体方程,我们可以将压力和体积联系起来。
$\mathrm{PV = nRT}$
$\mathrm{P=\frac{nRT}{V}}$
现在,我们可以将此值代入所做功的表达式。
$\mathrm{W=\int\:\frac{nRT}{V} dV}$
由于摩尔数、温度和 R 是常数,我们可以将它们从积分中去掉。因此,
$\mathrm{W=nRT\:ln \:ln V |_{V_1}^{V_2}=nRT\:ln\:ln (\frac{V_2}{V_1})}$
因此,等温过程中所做的功由下式给出:
$\mathrm{W=nRT\:ln\:ln(\frac{V_2}{V_1})}$
什么是绝热过程?
“绝热”一词源于希腊语“adiabatos”,意思是不可逾越的。在这个过程中,不会发生热量或物质的转移。系统不会从其周围环境获得或损失热能,也不会交换物质。
极其快速发生的过程几乎没有热交换,因此在各种情况下都可以进行“绝热近似”,使它们易于求解。
绝热过程的例子
冰盒中的冰
为了使冰盒中的软饮料保持冰冷,我们把冰放在里面并盖上盖子。现在,热量不会进出系统,因此系统变成了绝热系统。
声音在空气中的传播
声音在气体中传播的速度非常快,因此没有时间发生热交换。因此,声音在气体中的传播是绝热过程。
绝热过程中所做的功
对于绝热过程,压力和体积之间的关系如下:
$\mathrm{PV^{\gamma}=K}$
其中 K 是一个常数。我们可以使用此关系来求解所做功的表达式:
$\mathrm{W=\int\:\:P \cdot dV=K \int \frac{1}{V-\gamma}dV=\frac{K}{1-\gamma}(V_2^{1-\gamma}-V_1^{1-\gamma})}$
可以使用理想气体方程得出 K 的表达式:
$\mathrm{P_1 V_1^{\gamma}=P_2 V_2^{\gamma}=K}$
$\mathrm{PV=nRT}$
因此,
$\mathrm{W=\frac{1}{1-\gamma}(P_2 V_2-P_1 V_1)}$
结论
热力学是研究热、功、温度及其与能量、熵和物质之间关系的科学。我们对热力学的了解可以总结成一套四条规则,称为热力学定律。
等温过程发生在温度不变的情况下,即使系统损失或获得热量。一个常见的例子是通过熔化将固体转变为液体。等温过程的功由以下方程给出:
$\mathrm{W=nRT\:ln\:ln(\frac{V_2}{V_1})}$
绝热过程定义为系统与其环境之间不传递热量或物质的过程。声音在空气中的传播速度太快,无法进行热交换,因此它是绝热的。在这种情况下,所做功的表达式是:
$\mathrm{W=\frac{1}{1-\gamma}(P_2 V_2-P_1 V_1)}$
常见问题
Q1. 等温过程和绝热过程的基本区别是什么?
A1. 等温过程在恒定温度下发生,但可以发生热交换。然而,绝热过程中不能发生热交换,即使温度发生变化。
Q2. 热交换如何在等温过程中发生?
A2. 当热量以极慢的速度流入或流出系统时,不会发生温度变化,因此该过程变为等温过程。
Q3. 冰箱是绝热系统吗?
A3. 不是。冰箱是等温系统。冰箱的内容物保持在恒定温度,热量被排出。
Q4. 所做功采用什么符号约定?
A4. 在物理学中,如果系统做了功,则热力学功为正;如果对系统做了功,则热力学功为负。
Q5. 绝热过程方程中的伽马 $\mathrm{(\gamma)}$ 项是什么?
A5. $\mathrm{\gamma}$ 代表绝热指数。要计算它,只需将恒压比热除以恒容比热。也就是说,$\mathrm{\gamma=\frac{C_p}{C_v}}$


 数据结构
数据结构 网络
网络 关系数据库管理系统 (RDBMS)
关系数据库管理系统 (RDBMS) 操作系统
操作系统 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C语言编程
C语言编程 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP