轨道与轨道的区别
简介
我们经常将轨道与轨道混淆,认为它们是相同的事物,但这完全是一种误解。轨道和轨道之间存在重大差异。我们知道电子围绕原子核旋转,电子旋转的这些路径称为轨道。在这些路径中,存在一个电子存在的特定空间。这些三维图形中的空间称为轨道。我们将以更广泛的方式理解这一点,让我们来理解这个概念。
什么是轨道?
我们知道,在原子结构中,存在电子、原子核和质子。电子带负电,它们围绕带正电的原子核旋转。但是这些电子是如何旋转的,以及在哪里找到它们,我们需要理解这一点。原子核周围存在不同的能级;这些电子在不同的能级上旋转。这些能级称为轨道。在玻尔原子模型中,这些不同的能级被称为 K、L、M、N 等。

什么是轨道?
正如我们所理解的那样,原子核周围存在不同的能级,电子在其中旋转,但这些电子在该空间的不同区域存在。在三维空间中,这些区域具有不同的能量,这些区域称为轨道。这些轨道具有不同的形状和能量。这些轨道只能容纳少数电子。根据海森堡不确定性原理,电子没有确切的位置。这些电子在分子内移动,随着电子能级的变化而变化。
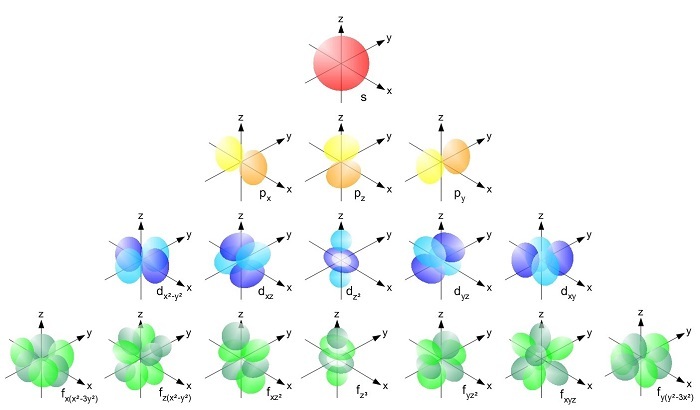
轨道的不同形状
分子中的电子在不同的能级上旋转。这些能级或电子层具有不同的轨道形状。这些轨道有不同的类型,即 s、p、d 和 f、g、h 等。这些轨道具有不同的形状(钟形或球形、哑铃形等)。根据泡利不相容原理;一个轨道中只能存在两个电子。让我们了解更多关于它的信息。轨道的形状和类型取决于量子数,主量子数 (n) 和副量子数 (l)。其中 n 决定轨道的尺寸,l 决定轨道的形状。
s 轨道(锐) - s 轨道是球形且非方向性的,原子核位于中心。s 轨道的两个维度看起来像一个圆。s 轨道的尺寸取决于主量子数 (n) 的值。随着 n 值的增加,轨道的尺寸也随之增加。在 s 轨道中,l 的值为 0,m=0,因此,在所有方向上找到电子的可能性是相等的。
p 轨道 - 在 p 轨道中,n 的值大于 1,l 的值为 1。对于 n=2,l 的值为 1,m 的值为 1、0、-1。p 轨道有三种类型(2px、2py 和 2pz),呈哑铃形。p 轨道存在于所有量子数大于 1 的电子层中。
d 轨道 - d 轨道中有 5 个轨道。一个 d 轨道呈哑铃形,中间有一个环面,另外四个像一个四叶草,指向不同的方向。d 轨道从量子数 n=3 和 l=2 开始出现。这些轨道分别命名为 dxy、dyz、dzx、dx2-y2 和 dz2。在 d 轨道中,所有轨道的能级相同。
f 轨道 - 在 f 轨道中有 7 个轨道,3 个轨道呈哑铃形,中间有两个环面,另外 4 个像是一束绑在一起的气球。f 轨道从量子数 n=4 和 l=3 开始出现。
轨道与轨道的区别
我们经常将轨道与轨道混淆,但两者之间存在差异。让我们更简洁地检查一下。
| 轨道 | 轨道 |
|---|---|
| 轨道是电子围绕原子核旋转的不同能级的路径。 | 轨道是电子存在的三维结构中的区域。 |
| 轨道具有相同的形状,即椭圆形。 | 轨道具有不同的形状,球形、哑铃形、钟形等。 |
| 轨道被分为不同的能级,如 K、L、M、N 等。 | 轨道被分类为 s、p、d、f、g、h 等。 |
| 在轨道中,海森堡不确定性原理不适用。 | 在轨道中,海森堡不确定性原理适用。 |
| 在轨道中,没有方向。 | 在轨道中,在 x、y 和 z 轴上有方向。 |
结论
在本教程中,我们讨论了轨道和轨道之间的区别。我们得出的结论是,轨道是不同能级电子围绕原子核旋转的路径。轨道是电子存在于空间中的特定区域。轨道具有不同的形状,钟形、哑铃形、球形和四叶草形。形状、大小和方向决定了轨道的形状,即 s、p、d、f 等。轨道的尺寸取决于主量子数和副量子数。随着量子数的值增加,轨道的尺寸也随之增加。
常见问题
1. d 亚层有多少个轨道?
在 d 亚层中,有五个轨道,总共存在十个电子。这些轨道分别命名为 dxy、dyz、dzx、dz2 和 dx2-y2。d 亚层呈哑铃形,中间有环面,其他呈四叶草形。
2. 什么是量子数?
用于确定原子中电子位置和能级的数字称为量子数。两个重要的量子数决定了电子在原子中的位置。主量子数 (n) 和副量子数或角动量量子数 (l)。
3. 什么是主量子数?
主量子数是电子的能量以及电子到原子核的距离。它用 n 表示。轨道中的电子由 2n2 决定,n 是一个整数,除了零,即 n 可以是 1、2、3、4、5、……等。
4. 什么是亚层?
轨道进一步细分为小的电子层,这些称为亚层。就像轨道被分为 s、p、d、f、g 电子层一样,这些电子层又被进一步细分为小的部分。p 电子层有三个亚层,即:2px、2py、2pz。
5. f 电子层有多少个亚层?
f 电子层有 7 个亚层,包含 14 个电子。在这些轨道中,四个是绑在一起的八个气球的束,三个是哑铃形的,中间有两个环面。


 数据结构
数据结构 网络
网络 关系型数据库管理系统
关系型数据库管理系统 操作系统
操作系统 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C 语言编程
C 语言编程 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP