元素的电子构型和轨道的稳定性
引言
原子的电子构型由其电子在轨道和壳层中的排列方式决定。从原子中移除一个e⁻所需的能量决定了轨道的稳定性。能量级别越高,轨道越稳定。
原子核中质子的数量决定了原子的电子结构。原子的原子序数基于其原子核中质子的数量。原子中的电子数量也基于其原子核中质子的数量。
电子构型的标准表示法
电子构型的表示法是按照原子序数递增的顺序列出元素,然后列出轨道中的电子,从最低能量级别到最高能量级别。例如,碳的电子构型为1s2 2s2 2p2。
电子构型表示法中的第一个数字表示元素的原子序数。第二个数字表示第一能级中的电子数。第三个数字表示第二能级中的电子数,以此类推。
原子轨道
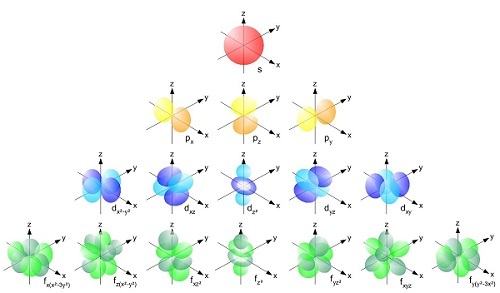
电子的运动比看起来更复杂。它们总是遵循一组预定的路径,称为轨道或亚层。这些轨道有多种形状,包括s、p、d和f轨道。第一能级只有一个s轨道,而第二能级则有一个s轨道和三个p轨道。第三能级与第二能级类似,有三个p轨道和五个d轨道。其中能量最低的是s轨道。
每种类型的轨道最多可以容纳两个电子。
s轨道围绕原子核,呈球形。p轨道有两个叶瓣,形状像哑铃。d轨道是由四个叶瓣组成的轨道。
在原子中,电子首先占据能量最低的轨道。原子中的电子首先占据s轨道,然后是p轨道,最后是d轨道。s轨道有两个电子,p轨道有六个电子。
haade, 单电子轨道, CC BY-SA 3.0
电子构型规则
原子的电子构型由其电子在外层和内层中的排列方式决定。可以使用电子构型规则来确定原子的电子构型。
四个原则支配着电子构型:
根据第一条规则,电子总是首先占据能量最低的能级。
根据第二条规则,电子先占据壳层,然后占据亚层。
第三条规则规定,一个壳层最多只能容纳两个电子。
第四条规则规定,一个亚层最多只能容纳八个电子。
可以将确定电子构型的规则应用于原子。第一步是确定有多少个壳层。原子核中质子的数量影响壳层的数量。第二步是计算亚层的数量。原子中电子的数量决定了它有多少个亚层。第三步是找出原子在每个壳层和亚层内的电子构型是如何组织的。
泡利不相容原理
泡利不相容原理指出,原子中没有两个电子可以具有相同的一组四个量子数。一个轨道中只能有两个电子,并且它们必须具有相反的自旋。
泡利不相容原理有两条规则:
同一个轨道被两个电子占据。
在同一个轨道中的两个电子具有反平行自旋或相反的自旋。
除了电子外,其他具有半整数自旋的粒子也遵循泡利不相容原理。
洪特规则
洪特规则指出,在具有相同亚层的轨道中,电子的配对不会发生,直到该亚层中的每个轨道至少有一个电子。例如,当有三个p轨道、五个d轨道和七个f轨道时,电子配对从f轨道(第八个电子)、d轨道(第六个电子)和p轨道(第四个电子)开始。
当这些轨道中的电子被填满时,首先用具有相同自旋的一个电子填充包含每个轨道中两个电子的亚层。一旦所有亚层都已填充完毕,每个能级中的电子场就会用相反极性的电子加倍。例如,具有3个亚层的p轨道将会有三个具有相同自旋的电子,其余三个电子将依次放置在具有相反自旋的亚层中。
构造原理
构造原理指出,电子以能量递增的顺序填充其基态。首先占据能量级别最低的原子轨道,而不是能量级别较高的轨道。
构造原理指出,能量最低的电子首先占据位置。
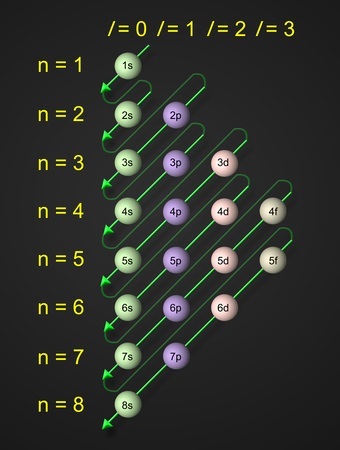
可以使用n+l规则计算轨道能量的增长。轨道的不同能级由主量子数和角量子数之和决定。
较低的轨道能量与较低的n+l值相关。如果两个轨道的n+l值相同,则n值较低的轨道被认为能量较低。
电子的填充顺序为:1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p等。
什么是稳定的电子构型?
原子的稳定性可以通过其电子排列来预测。为了使原子最稳定和最不活泼,其所有轨道都必须被占据。最稳定的电子形式也具有完全填充的能级。惰性气体具有许多这样的轨道构型,这使得它们难以与其他化学物质轻易结合。
每当两个或多个原子相互接触时,首先相互作用的是价层,即原子的外层电子。当原子的价层被填满时,原子处于最稳定的状态。价电子控制着元素的化学行为。例如,具有相同价电子的元素表现出相似的化学特性。
阴离子和阳离子的构型
离子是由于获得或失去一个或多个电子而带电的原子(或原子团)。当原子获得电子时,会带负电荷。如果失去电子,则带正电荷。
创建中性原子的电子结构,然后添加(对于负离子)或移除(对于正离子)电子。
负离子
$$\mathrm{Cl: 1s^2 2s^2 2p^6 3s^2 3p_x^2 3p_y^2 3p_z^1,\: 但\: Cl^-\: 多了一个电子}$$
$$\mathrm{ Cl^-: 1s^2 2s^2 2p^6 3s^2 3p_x^2 3p_y^2 3p_z^2}$$
正离子
$$\mathrm{Ca: 1s^2 2s^2 2p^6 3s^2 3p^6 4s^2,\: 但\: Ca^{2+}\: 少了两个电子}$$
$$\mathrm{Ca^{2+}: 1s^2 2s^2 2p^6 3s^2 3p^6}$$
结论
惰性气体的八电子构型被称为惰性气体构型。化学元素获得稳定性的倾向是所有化学反应的基础。当一些主族元素之间形成化学键时,结果通常是类似于惰性气体的标准电子构型。
每个系统都倾向于达到稳定或低能量状态,这就是为什么化学元素参与化学反应以达到类似于附近惰性气体的稳定电子构型的原因。
常见问题
1. 如何判断物质是否稳定?
如果原子核的组成部分之间的力是平衡的,则原子是稳定的。如果这些力不平衡或原子核具有过多的内能,则原子是不稳定的。过多的中子或质子会使原子的原子核不稳定。
2. 为什么5d轨道先于4f轨道填充?
轨道按能量顺序填充。因为在某些情况下,5d能级有时低于4f能级,所以5d轨道先于4f轨道填充。并非所有镧系元素都发生这种情况。
3. 为什么会形成具有8个电子的稳定壳层?
因为它们的电子结构与最接近的惰性气体相似,所以价层中具有八个e-的原子具有充满的最外层轨道,因此是最稳定的。
4. 哪些原子可以维持少于八个价电子的数量?
原子通常遵循八隅律,但也有例外。例如,硼或铍等元素经常形成化合物(如BF3或BeH2),其中中心原子周围的电子少于八个。
5.是什么使惰性气体稳定?
由于这些原子的价电子层已满,使得它们非常稳定,并且减少了它们接受或失去电子的倾向,因此惰性气体也极难形成化学键。


 数据结构
数据结构 网络
网络 关系数据库管理系统 (RDBMS)
关系数据库管理系统 (RDBMS) 操作系统
操作系统 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C语言编程
C语言编程 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP