前30个元素的电子构型
简介
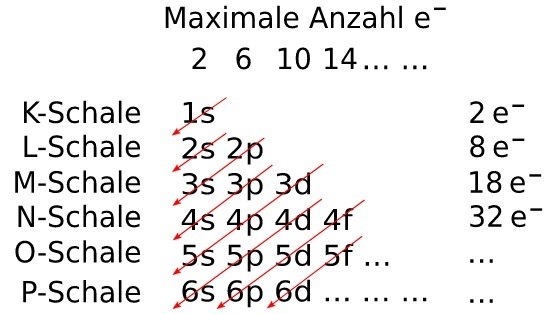
原子的电子构型显示围绕原子核的每个亚层有多少个电子。在用s、p、d和f符号表示的轨道中,可以找到的最大电子数分别为2、6、10和14。该符号用于描述亚层的电子数。壳层数、亚层的身份以及亚层中电子的总数都写在右上角。电子构型,通常称为电子结构,是围绕原子核的不同能级上电子的构型。
什么是电子构型?
电子构型或电子结构是指围绕原子核在不同能级上电子的排列。分子的电子构型是由不同分子轨道中电子的排列决定的。它的重要性怎么强调都不为过。分子或分子离子的电子构型可用于计算键合和反键合分子轨道中的电子数。
理解电子构型
每个壳层都分配了一个值,即主量子数“n”。这意味着第一壳层的n=1,第二壳层的n=2,第三壳层的n=3,依此类推。
| n | 1 | 2 | 3 | 4... |
|---|---|---|---|---|
| 壳层 | K | L | M | N… |
每个亚层都有一个称为角量子数或“l”的值,并且一个壳层中亚层的数量等于该壳层的主量子数。对于第一壳层,n=1,这意味着只有一个可能的亚层,并且“l”的值为0。第二壳层的“l”值为0和1,亚层数量为2。以此类推。我们有与每个“l”值对应的符号,例如
| “l”值 | 零 | 一 | 二 | 三 | 四 |
|---|---|---|---|---|---|
| 亚层符号 | s | p | d | f | g |
因此,不同亚层的表示法如下:
| 壳层 (n) | l | 亚层表示法 |
|---|---|---|
| 一 (1) | 零 (0) | 1s |
| 二 | 零 (0) | 2s |
| 一 (1) | 2p | |
| 三 | 零 (0) | 3s |
| 一 (1) | 3p | |
| 二 (2) | 3d |
现在,我们将排列这些电子,以便它们以显示其能量和已容纳它们的轨道的性质的方式围绕原子核排列。
| 主能级 (n) | 亚层类型 | 每种类型的轨道数 | 每能级轨道总数 $\mathrm{n^{2}}$ | 最大电子数 $\mathrm{2n^{2}}$ |
|---|---|---|---|---|
| 第一 (1) | s | 一 | 一 | 二 |
| 第二 (2) | s | 一 | 四 | 八 |
| p | 三 | |||
| 第三 (3) | s | 一 | 九 | 十八 |
| p | 三 | |||
| d | 五 | |||
| 第四 (4) | s | 一 | 十六 | 三十二 |
| p | 三 | |||
| d | 五 | |||
| f | 七 |
填充顺序
填充电子以编写元素的电子构型时,遵循Aufbau原理、泡利不相容原理和洪特规则。
File:Klechkovski_rule.svg,未提供机器可读作者,User:Bono~commonswiki,假设(基于版权声明)。衍生作品:MikeRun,Klechkovski规则详细信息 DE,CC BY-SA 3.0
氧的八个电子按照以下步骤进入:1s、2s,最后是2p。因此,电子构型将是𝑂 $\mathrm{1s^{2}2s^{2}2p^{4}}$。
可以使用惰性气体来编写元素的电子构型
例如,由于氖的电子构型是$\mathrm{1s^{2}2s^{2}2p^{6}}$,硫的电子构型可以表示为$\mathrm{[Ne]3s^{2}3p^{4}}$。
显示前30个元素电子构型的表
| 氢 | 一 | 一 | ||||||
| 氦 | 二 | 二 | ||||||
| 锂 | 三 | 二 | 一 | |||||
| 铍 | 四 | 二 | 二 | |||||
| 硼 | 五 | 二 | 二 | 一 | ||||
| 碳 | 六 | 二 | 二 | 二 | ||||
| 氮 | 七 | 二 | 二 | 三 | ||||
| 氧 | 八 | 二 | 二 | 四 | ||||
| 氟 | 九 | 二 | 二 | 五 | ||||
| 氖 | 十 | 二 | 二 | 六 | ||||
| 钠 | 十一 | 二 | 二 | 六 | 一 | |||
| 镁 | 十二 | 二 | 二 | 六 | 二 | |||
| 铝 | 十三 | 二 | 二 | 六 | 二 | 一 | ||
| 硅 | 十四 | 二 | 二 | 六 | 二 | 二 | ||
| 磷 | 十五 | 二 | 二 | 六 | 二 | 三 | ||
| 硫 | 十六 | 二 | 二 | 六 | 二 | 四 | ||
| 氯 | 十七 | 二 | 二 | 六 | 二 | 五 | ||
| 氩 | 十八 | 二 | 二 | 六 | 二 | 六 | ||
| 钾 | 十九 | 二 | 二 | 六 | 二 | 六 | 一 | |
| 钙 | 二十 | 二 | 二 | 六 | 二 | 六 | 二 | |
| 钪 | 二十一 | 二 | 二 | 六 | 二 | 六 | 一 | 二 |
| 钛 | 二十二 | 二 | 二 | 六 | 二 | 六 | 二 | 二 |
| 钒 | 二十三 | 二 | 二 | 六 | 二 | 六 | 三 | 二 |
| 铬* | 二十四 | 二 | 二 | 六 | 二 | 六 | 五 | 一 |
| 锰 | 二十五 | 二 | 二 | 六 | 二 | 六 | 五 | 二 |
| 铁 | 二十六 | 二 | 二 | 六 | 二 | 六 | 六 | 二 |
| 钴 | 二十七 | 二 | 二 | 六 | 二 | 六 | 七 | 二 |
| 镍 | 二十八 | 二 | 二 | 六 | 二 | 六 | 八 | 二 |
| 铜* | 二十九 | 二 | 二 | 六 | 二 | 六 | 十 | 一 |
| 锌 | 三十 | 二 | 二 | 六 | 二 | 六 | 十 | 二 |
关于电子构型的知识
电子在元素中的位置取决于其电子排列。
电子的能级按从低到高的顺序排列。
元素的电子结构在决定其原子序数方面起着重要作用。
元素的电子构型决定了其电子在其内的位置。
电子的能级按从低到高的顺序排列。
元素的原子序数主要由元素的电子结构决定。
具有完全占据的最外层电子的惰性气体,包括𝑁𝑒、𝐴𝑟和𝐻𝑒,是最稳定的。惰性气体的惰性是由于其完整的价层。
𝐶𝑢和𝐶𝑟都具有异常的电子结构,其中3d轨道在4s轨道之前填充。$\mathrm{Cu[Ar]3d^{10}4s^{1}}$和$\mathrm{Cr.[Ar]3d^{5}4s^{1}}$更稳定。
结论
原子的电子构型显示围绕原子核的每个亚层有多少个电子。在用s、p、d和f符号表示的轨道中,可以找到的最大电子数分别为2、6、10和14。电子构型是使用洪特规则、Aufbau原理和泡利不相容原理编写的。
常见问题
1. 从𝑁𝑎或𝐴𝑙去除电子更容易吗?
从𝑁𝑎原子中去除1个电子并产生充满壳层的𝑁𝑎+离子不需要太多能量。铝的第二和第三电离能也远高于其第一电离能。
2. 钛的原子序数是多少?
𝑇𝑖的原子序数为22,电子结构为$\mathrm{1s^{2}2s^{1}2p^{6}3s^{2}3p^{6}3d^{2}4s^{2}}$
3. 轨道和壳层是否等同?
电子的轨道是它围绕原子核运行的明确定义的圆形路径。它的另一个名称是壳层。它用“n”(主量子数)表示。要从一个轨道移动到另一个轨道,电子必须吸收或释放能量。
4. 是否可以识别没有中子的原子?
唯一一个没有中子的稳定原子是氢原子。所讨论的氢同位素称为氕。氕是最简单的原子,它只有一个质子和一个电子。
5. 存在多少种不同类型的电子构型?
有三种表达电子构型的方法:spdf表示法、惰性气体表示法和轨道图。


 数据结构
数据结构 网络
网络 关系数据库管理系统 (RDBMS)
关系数据库管理系统 (RDBMS) 操作系统
操作系统 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C语言编程
C语言编程 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP