酸碱性质实验
介绍
酸碱性质实验是化学中最重要的话题之一。通常,尝起来酸的化学物质会将蓝色石蕊试纸变红,这些物质被称为酸。类似地,尝起来苦的碱会将红色石蕊试纸变蓝。酸和碱相互反应会生成盐和水。这表明中和作用,即碱和酸都中和成水的pH值。
如果不对这些事实进行测试和实验,它们只会停留在假设阶段。因此,本文将包含酸碱性质实验。将进行三个实验,每个实验都使用HCl作为酸,NaOH作为碱。这些将与石蕊试液(蓝/红)、锌金属和碳酸钠(固体)等化合物一起测试。
酸碱性质实验所需材料
进行酸碱性质实验需要各种材料,包括:
火柴盒
滴管
试管架
试管夹
酒精灯
分液漏斗
石蕊试液或试纸(红色和蓝色)
试管
平底烧瓶
锌粒
石灰水(现配现用)
烧杯
碳酸钠(固体)
稀NaOH溶液
稀HCl溶液

图1:所需化学药品和材料清单
(Nefronus, 锌样品, CC0 1.0) (Ondřej Mangl, 碳酸钠, 标记为公共领域,更多详情请见维基共享资源) (Walkerma at en.wikipedia, 盐酸 04, 标记为公共领域,更多详情请见维基共享资源) (Ondřej Mangl, 氢氧化钠, 标记为公共领域,更多详情请见维基共享资源) (Deamit, 使用石蕊试纸测定水样pH值, CC BY 4.0)
什么是酸?

图2:常见的无机酸和乙酸
溶于水后生成带正电荷的水合氢离子(H3O+)的化合物称为酸。
例如,HNO3释放NO3-和H+离子,就像HCl释放H+和Cl-离子一样。
酸的性质实验
实验1:石蕊试验
取两个试管,并将它们放在试管架上。
现在,将两个试管分别标记为1和2。
取试管1,加入5毫升蓝色石蕊试液。
现在在试管2中加入5毫升红色石蕊试液。
现在,用滴管吸取HCl溶液,在试管1和2中分别加入等量。
仔细观察试管中颜色的变化。
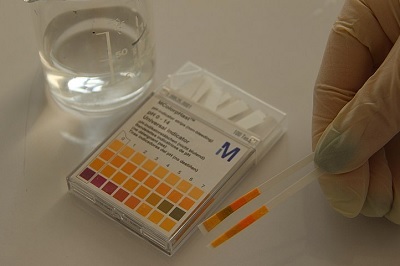
图3:石蕊试验
Deamit, 使用石蕊试纸测定水样pH值, CC BY 4.0
实验2:碳酸钠(固体)
取一个平底烧瓶,加入1克碳酸钠和少量蒸馏水。
现在取一个(干燥的双孔)软木塞。这个软木塞应该适合分液漏斗。此外,还应在其上安装一个导气管。
现在,用干燥的双孔软木塞塞住平底烧瓶的瓶口。然后加入2毫升HCl气体。
释放的气体无色无味。然后,该气体通过石灰水和导气管。
通过石灰水后,石灰水开始变浑浊。
该实验涉及的反应是
$$HCl + Na_2CO_3 \rightarrow 2NaCl + H_2O(液态) + CO_2(气态)$$

图4:碳酸钠对HCl酸的作用
实验3:锌
取一个(干净干燥的)试管,放入锌粒。
将HCl溶液(液态)倒入试管中,使锌粒浸没在其中。
现在稍微倾斜试管,并用软木塞将其塞紧。
将本生灯固定在试管上,然后点燃。
现在将试管口紧紧塞住。这应确保没有蒸汽逸出。
放置溶液2-3分钟后,它会发出强烈的燃烧声,并释放出无色无味的气体。
现在,如果你在试管口前燃烧一根火柴,你会看到淡蓝色的火焰,然后听到爆裂声。
以下是上述实验中涉及的反应
$$Zn + 2HCl \rightarrow ZnCl_2 + H_2\uparrow$$
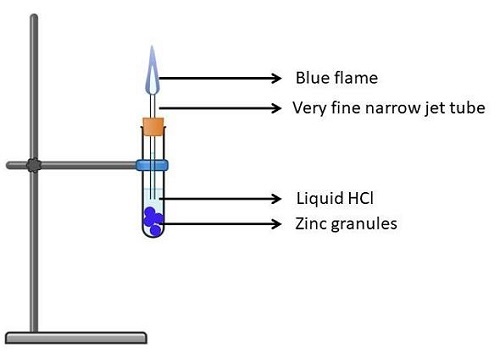
图5:Zn对HCl酸的作用
什么是碱?
图6:强碱和弱碱(颜色用于区分,并非基于任何科学意义)
溶于水后生成带负电荷的氢氧根离子(OH-)的化合物称为碱。
例如,NaOH释放Na+和OH-离子。
碱的性质实验
实验1:石蕊试验
取两个试管,并将它们放在试管架上。
现在,将两个试管分别标记为1和2。
取试管1,加入5毫升红色石蕊试液。
现在在试管2中加入5毫升红色石蕊试液。
现在,用滴管吸取NaOH溶液,在试管1和2中分别加入等量。
仔细观察试管中颜色的变化。
实验2:碳酸钠(固体)
取一个平底烧瓶,加入1克碳酸钠和少量蒸馏水。
现在取一个(干燥的双孔)软木塞。这个软木塞应该适合分液漏斗。此外,还应在其上安装一个导气管。
现在,用干燥的双孔软木塞塞住平底烧瓶的瓶口。然后加入稀NaOH溶液(液态)。
不会发生任何变化,即不会发生反应。
实验3:锌
取一个(干净干燥的)试管,放入锌粒。
将NaOH溶液(液态)倒入试管中,使锌粒浸没在其中。
现在稍微倾斜试管,并用软木塞将其塞紧。
将本生灯固定在试管上,然后点燃。
现在将试管口紧紧塞住。这应确保没有蒸汽逸出。
放置溶液2-3分钟后,它会发出强烈的燃烧声,并释放出无色无味的气体。
现在,如果你在试管口前燃烧一根火柴,你会看到淡蓝色的火焰,然后听到爆裂声。
以下是上述实验中涉及的反应:
$$2NaOH + Zn \rightarrow Na_2ZnO_2 + H_2\uparrow$$
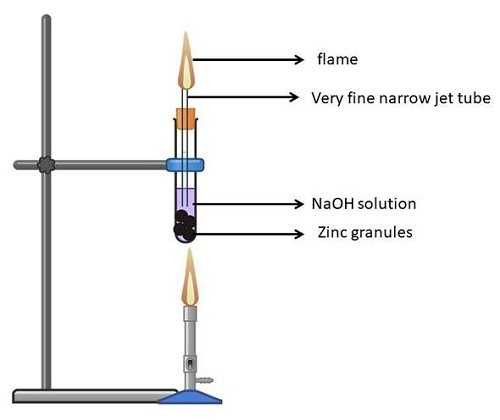
图7:Zn对NaOH的作用
注意事项
由于大量产生的氢气会导致爆炸,因此应确保使用少量反应物(NaOH、HCl、Zn)。
使用细喷嘴燃烧氢气。
只有在确保装置完全密闭后,才能将HCl加入碳酸钠中。
处理NaOH和HCl等化学药品时应小心,因为它们会造成伤害。
观察结果
| 实验 | 酸 | 碱 |
|---|---|---|
| 实验1:石蕊试验 | 蓝色石蕊试液与盐酸反应后变红。 | 红色石蕊试液与NaOH反应后变蓝。 |
| 实验2:碳酸钠(固体) | HCl与碳酸钠反应释放CO2。 | NaOH与碳酸钠反应没有观察到反应。 |
| 实验3:锌 | HCl与锌反应生成ZnCl2和H2气体。 | NaOH与锌反应生成锌酸钠和H2气体。 |
结论
盐酸与蓝色石蕊试液反应实验中,溶液变红。类似地,与碳酸钠反应时,会释放CO2。此外,HCl与锌反应会释放ZnCl2和H2气体。因此,证明了HCl的酸性。
类似地,NaOH与红色石蕊试液反应会使其变蓝。与碳酸钠反应时,NaOH没有反应。最后,NaOH与锌反应生成锌酸钠和H2气体。因此,NaOH表现出所有碱的性质。
常见问题
Q1. 如何通过实验鉴定酸和碱?
A1. 有多种实验可以鉴定酸和碱。其中一种是石蕊试验。使用蓝色石蕊试液可以鉴定酸,使用红色石蕊试液可以鉴定碱。因为蓝色石蕊与酸反应后变红,红色石蕊与碱反应后变蓝。
Q2. 酸碱指示剂的重要性是什么?
A2. 酸碱指示剂在滴定实验中用于确定反应的终点。它们也有助于测量不同化合物的pH值。此外,酸碱指示剂还有助于在科学中进行引人入胜的变色演示。
Q3. pH值有可能为负值吗?
A3. 尽管pH值的范围仅为0-14,但可以计算出负的pH值。在氢离子摩尔浓度大于1N的酸中,有可能出现负的pH值。


 数据结构
数据结构 网络
网络 关系数据库管理系统 (RDBMS)
关系数据库管理系统 (RDBMS) 操作系统
操作系统 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C语言编程
C语言编程 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP