(a) 说明碳既不能形成C4+ 阳离子,也不能形成C4– 阴离子,而是形成共价键的原因。此外,说明共价化合物(i) 导电性差。(ii) 熔点和沸点低的原因。(b) 写出苯(C6H6)的结构式。
(a) 碳不能形成C4+ 阳离子,因为 失去 4 个电子需要大量的能量。
碳不能形成C4- 阴离子,因为它 对于其具有 6 个质子的原子核来说,很难容纳 10 个电子。
因此,碳原子 共享电子并形成共价化合物。
(i) 共价化合物不离解成离子,因此不能导电。
(ii) 碳原子之间的分子间作用力较弱。因此,它们的熔点和沸点较低。
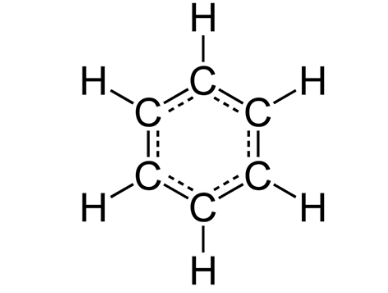
(b) 苯(C6H6)的结构式。

广告

 数据结构
数据结构 网络
网络 关系数据库管理系统
关系数据库管理系统 操作系统
操作系统 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C 编程
C 编程 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP