原子半径的周期性趋势
引言
了解原子半径有助于我们预测原子的反应活性水平。半径越小,反应活性就越强。本文涵盖了化学元素原子半径的所有方面。下面将讨论元素周期表中的规律、不同类型的半径等等。
定义原子半径和原子大小
元素周期表是一个有组织的参考表格。它包含按原子序数从小到大排列在不同族中的元素。分子核心中的质子数量就是原子序数。原子半径定义为在孤立条件下,从原子核到原子外层电子壳层中最外层电子的距离的测量值。元素周期表中,从左到右,原子序数逐渐增加。但是,元素周期表中从左到右原子大小减小。从上到下,原子序数和原子大小都增加。请参考下图。
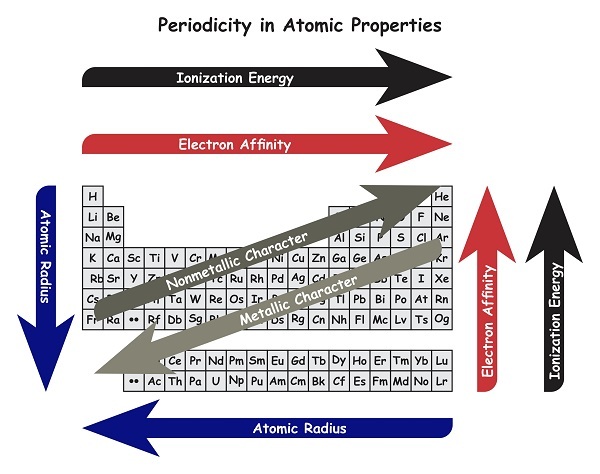
什么是半径和原子半径?
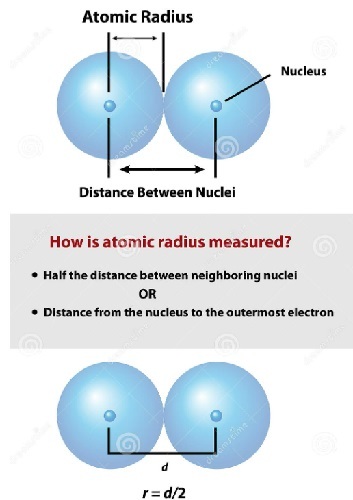
首先,半径这个术语与几何图形圆有关。其次,原子半径的特征是将原子的外观近似为球体。球体是三维投影的圆。圆的半径是如何定义的,原子半径的定义又有什么不同呢?
直径是圆上两点之间穿过圆心的线段,半径是直径的一半。原子包含不同形状的电子壳层,一个套着一个,因此原子的半径是用最外层电子壳层中的孤立电子来测量的,如下图所示。因此,从原子核中心到原子外层电子壳层的距离称为原子半径。
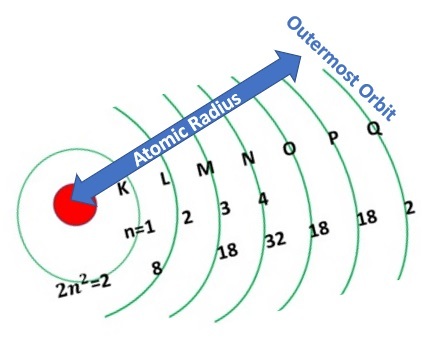
半径类型
存在许多流行的原子半径概念。如前所述,由于可用信息有限,很难精确预测原子的形状和结构。用圆或球体来近似是一种方法。让我们在下文中详细了解这些概念。
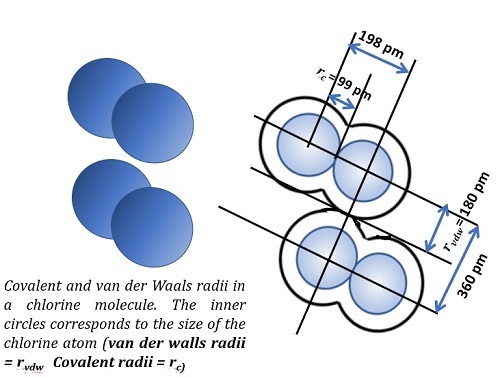
范德华半径
这个概念定义为两个处于非键合状态的相邻原子核之间的距离。请看下图中这两个非键合的原子是如何键合到化合物分子中的。
离子半径
离子键是一种电价键,其中两个带相反电荷的离子相互吸引形成键。这种键并非存在于元素态,而存在于化合物态。正离子和负离子原子核之间的距离被认为是离子半径的两倍。
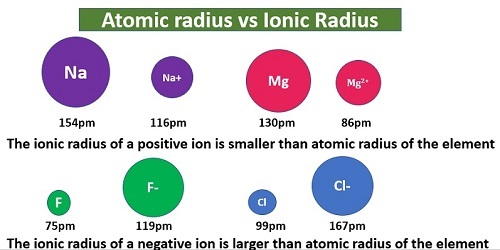
共价半径
在共价键的情况下,原子半径的概念保持不变,只是化合物的形成是通过共享电子实现的。
金属半径
这里,金属簇是区分元素的关键。其余都保持不变。金属簇中原子之间的结合与通过连接相反极性离子形成的离子键或通过共享电子形成的共价键完全不同。在金属键合中,正离子的密集结构共享松散分布的电子。因此,金属半径是两个金属离子键长的一半。
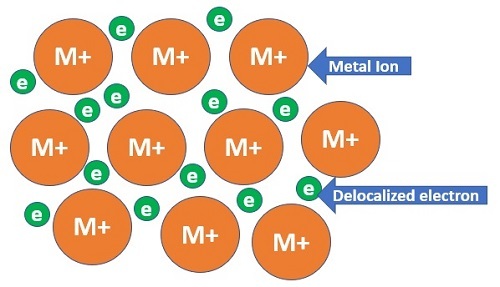
原子大小和原子半径的区别
原子大小是原子的尺寸。利用半径的测量值,我们可以理解原子的大小。有四种计算半径的方法。因此,让我们公平地了解这四种方法之间的区别,并将它们与原子大小联系起来。
| 序号 | 半径测量因素 | 范德华 | 离子 | 共价 | 金属 |
|---|---|---|---|---|---|
| 1 | 用键合原子还是非键合原子进行测量? | 非键合 | 键合 | 键合 | 键合的正离子 |
| 2 | 键合类型 | 原子间的弱力 | 正离子和负离子之间的吸引力 | 通过共享价电子进行键合 | 通过金属正离子簇和自由电子进行键合 |
| 3 | 键长 | 两个非键合原子之间 | 离子化合物中的两个原子之间 | 共价化合物中的两个原子之间 | 金属正离子簇的两个原子之间 |
| 4 | 半径 | 键长的一半 | 键长的一半 | 键长的一半 | 键长的一半 |
表1:计算半径的四种方法的比较
结论
讨论了与圆相关的原子半径和半径的一般概念。详细解释了不同类型的半径概念。原子大小与元素原子本身比与其作为化合物的存在更相关。共价半径或离子半径是两个相邻原子核之间平均距离。原子大小或多或少与上述相同,只是它是元素原子的半径。例如,如果可能存在半径为X埃的正离子(1埃=10-10米),并且相同元素的负离子半径为Y埃,则必须按原样表示为原子大小,而不是对两个值取平均值表示为原子半径。
常见问题
Q1. 原子大小或半径是用哪些不同的单位表示的?
A1. 埃(1埃=10-10米)和皮米(1皮米=10-12米)是用于表示原子半径和大小测量的两个单位。
Q2. 什么是玻尔半径?为什么它不被认为是一种半径?
A2. 玻尔半径仅适用于只有一个电子的原子,如氢和氦。尼尔斯·玻尔精确地找到了氢原子的这个测量值,它是一个常数,为5.29177 x 10-11米。
Q3. 即使使用高精度仪器,为什么原子半径测量仍然如此复杂?
A3. 根据海森堡不确定性原理,电子不会永久停留在其轨道上。因此,很难找到半径,因此测量的是化合物中两个键合原子核之间的距离。
Q4. 哪个元素具有最大的原子半径?
A4. 钫 (Fr) - 260 pm
Q5. 哪个元素具有最小的原子半径?
A5. 氦 (He) - 31 pm


 数据结构
数据结构 网络
网络 关系数据库管理系统 (RDBMS)
关系数据库管理系统 (RDBMS) 操作系统
操作系统 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C语言编程
C语言编程 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP