亚硫酸
引言
亚硫酸具有剧毒、腐蚀性和不可燃性,吸入过量会影响人体健康。如果酸接触皮肤,或吸入或摄入大量酸,则可能导致死亡。它会造成严重的皮肤烧伤,如果进入眼睛还会影响视力。亚硫酸还会释放刺激性、腐蚀性和有毒气体。
什么是亚硫酸?
亚硫酸是一种不稳定且弱的酸,它是二氧化硫溶于水后生成的。亚硫酸的化学式为“$\mathrm{H_{2}SO_{3}}$”,分子量约为“82.07 g/mol”。该酸的酸度为中性,因为它的酸性不是很强也不是很弱。“$\mathrm{H_{2}SO_{3}}$”是一种无色液体,具有强烈的刺鼻气味。
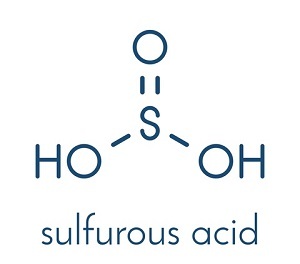
图1 - 亚硫酸的结构
该酸通常用作消毒剂、还原剂和造纸产品的生产。从“$\mathrm{SO_{2}}$溶液的拉曼光谱”可以看出,亚硫酸的信号强度与平衡一致。这种现象可以用下面提到的反应来表示。
$$\mathrm{“SO_{2}\:+\:H_{2}O\:\leftrightarrows\:H_{2}SO-_{3}\:+\:H^{+}"\:,\:其中\:"K_{a}\:=\:1.54\times\:10^{-2}"\:和\:"pK_{a}\:=\:1.81"}$$.
亚硫酸是二元酸,因为它倾向于产生“2个质子(H+)/分子”。该酸溶于水并释放一定量的热能,因为它对金属和组织具有腐蚀性。
亚硫酸的性质
亚硫酸的化学和物理性质列在下面。
| 亚硫酸的性质 | |
|---|---|
| “化学式” | $\mathrm{“H_{2}SO_{3}”}$ |
| “氢键供体数” | “2” |
| “分子量” | “82.07 g/mol” |
| “沸点” | “-60°C” |
| “密度” | “1.03 g/cm3 (20°C)” |
| “熔点” | “10°C” |
| “氢键受体数” | “4” |
| “单同位素质量” | “81.97 g/mol” |
| “蒸汽压” | “约21°C时为1740 kPa” |
| “溶解度” | “易溶于水” |
| 亚硫酸的用途 | 该酸广泛用作消毒剂、还原剂和温和的漂白剂。 |
表1:亚硫酸的性质
$\mathrm{“H_{2}SO_{3}"}$的一些常见化学性质如下所示。
亚硫酸的共轭碱包括“亚硫酸氢根(或亚硫酸氢根)和亚硫酸根离子”。亚硫酸常见阴离子的主要例子是“$\mathrm{HSO_{3}}$和$\mathrm{SO_{2}^{-3}}$”。
根据“17O核磁共振(核磁共振)波谱”的实验,人们已经了解到,“亚硫酸和质子化亚硫酸盐”的溶液由“异构体的组合”组成。异构体通常彼此处于“动态平衡”状态。
该酸在形成时本质上是不稳定的,并分解成各个部分。这种现象可以用反应表示为:
当该酸以较高的速率吸收氧原子时,它可以转化为“硫酸或硫酸盐”。
$$\mathrm{“H_{2}SO_{3}(aq)\:\rightarrow\:H_{2}O(I)\:+\:SO_{2}(g)"}$$
亚硫酸的制备
各种方法都突出了亚硫酸的形成,如下所述。
“二氧化硫的水溶液”可以确定为亚硫酸,其制备方法是将硫溶解在水中。这可以用反应表示为:
另一种制备“H2SO3”的方法是衍生“二氧化硫和亚硫酸氢钠盐”。然后将这些化合物引入“二氧化硫的水溶液”中形成亚硫酸,可以用反应表示为:
$$\mathrm{“SO_{2}\:+\:H_{2}O\:\longleftrightarrow\:H_{2}SO_{3}"}$$
$$\mathrm{“Na_{2}SO_{3}\:+\:H_{2}O\:+\:SO_{2}\:\rightarrow\:2NaHSO_{3}"}$$
亚硫酸的用途
“$\mathrm{H_{2}SO_{3}}$”的主要用途或应用如下所示。
亚硫酸通常用作漂白剂和还原剂。
该酸在世界各地的许多化工行业中被广泛用作中间体。
“$\mathrm{H_{2}SO_{3}}$”用作住宅和医疗部门的杀虫剂和消毒剂。
亚硫酸还有助于造纸产品的生产。
亚硫酸的影响
“$\mathrm{H_{2}SO_{3}}$”具有剧毒和腐蚀性,会以各种形式影响人类健康。该酸会造成严重的皮肤烧伤和眼睛损伤,可能导致“视力丧失”。过量“吸入和摄入”这种酸会导致刺激和疾病,例如“伴有痰的支气管炎、咳嗽、呼吸急促、呼吸道、心脏和肺部疾病”。为了防止危害,“$\mathrm{H_{2}SO_{3}}$”应储存在“+15°C至+25°C”的温度下,否则它会通过释放“有毒、刺激性和腐蚀性气体”来影响人体健康。
结论
亚硫酸还可以用其他名称识别,例如“二氧化硫溶液、二氢三氧化硫或三氧化硫酸”。该酸通常在“二氧化硫$\mathrm{(SO_{2})}$形成酸雨”的过程中作为中间体发挥作用。三氧化硫酸被确定为油状液体,外观清澈,具有“强烈燃烧的硫磺气味”。该酸对“组织和金属”具有很强的腐蚀性,密度为“1.03 g/cm3 (20°C)”。它还可以被称为“硫氧酸、磺酸互变异构体和亚硫酸氢根的共轭酸”。
常见问题
1. 亚硫酸的制备过程是什么?
亚硫酸作为酸雨的中间体形成,可以在实验室中自然和人工地产生。当大气中的“二氧化硫与水分结合”时,它就会形成。
2. 亚硫酸的主要健康危害是什么?
亚硫酸严重影响繁殖过程,如果“吸入或摄入”量较大。该酸还会刺激肺部和呼吸道,导致“伴有痰的支气管炎、咳嗽和呼吸急促”等疾病。
3. 如何判断亚硫酸是“强酸还是弱酸”?
亚硫酸$\mathrm{(H_{2}SO_{3})}$被认为是弱酸,不像“硫酸$\mathrm{H_{2}SO_{4}}$”,因为它在水溶液中不会完全解离成“$\mathrm{H+\:(H_{2}O+)}$和亚硫酸氢根离子”。这种现象意味着,当存在水基时,亚硫酸氢根离子在质子维持方面相当强。


 数据结构
数据结构 网络
网络 关系数据库管理系统(RDBMS)
关系数据库管理系统(RDBMS) 操作系统
操作系统 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C语言编程
C语言编程 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP