电子构型
简介
电子构型描述了原子亚层内电子的分布。预测围绕原子核的电子位置的概述称为电子构型。每个中性原子的电子数与质子数相同。现在,我们将这些电子进行排列,使它们围绕原子核,显示它们的能量以及它们所处的轨道类型。根据能量的不同,电子按照一定的顺序占据轨道。
什么是电子构型?
电子构型描述了原子亚层内电子的分布。
原子电子构型遵循一种标准方式,其中包含电子的每个原子亚层都按顺序列出。
对于高原子序数,电子构型的通常表示可能相当冗长。在某些情况下,可以使用简写/缩写符号来代替常规表示。
例如,Na的电子构型为$\mathrm{1s^2 2s^2 2p^6 3s^1}$。
亚层
电子在亚层中的分布由角量子数决定,用字母“l”表示。
主量子数n的大小决定了这个量子数的大小。因此,当n等于4时,可以存在四个不同的亚层。
因此,s、p、d和f亚层分别对应于n=4时的l=0,1,2,3。
亚层所能容纳的电子最大数量由公式2(2l+1)给出。
s、p、d和f亚层分别最多可以容纳2、6、10和14个电子。
编写电子构型
电子构型的书写遵循三套规则。它们规定了如何确定每个元素的电子构型。能级是电子围绕原子核旋转的能量已知的距离。随着距离原子核的距离增加,能级的相关能量也会增加。但是,对于多电子构型,电子能级图很难被所有人记住。
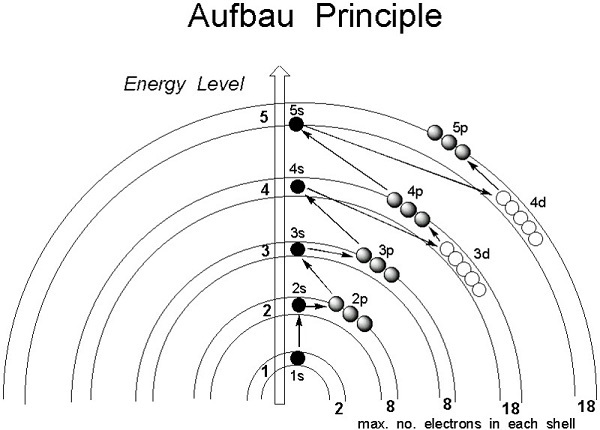
然而,通过理解Aufbau原理,可以描述电子构型。根据n+l规则,处于最低能量状态的原子中原子轨道的电子按能量递增的顺序占据轨道。能量随着轨道的n+l值的增加而增加。如果两个轨道具有相同的n+l值,则电子将首先填充n值较小的轨道,因为它具有较低的能量。因此,电子占据以下顺序:
$$\mathrm{1s,2s,2p,3s,3p,4s,3d,4p,5s,4d,5p,4f,5d,6p,7s…}$$
每个原子轨道最多只能容纳两个自旋相反的电子。
因此,第一层可以在1s中容纳两个电子。第二层在2s中容纳两个,在2p中容纳六个,总共可以容纳8个电子。
此外,在按照顺序将电子放入这些轨道时,也要遵循上述原则。
原子轨道的填充
以下概念支配着原子轨道中电子的占据方式。
Aufbau原理
原子轨道的能量由主量子数和角量子数之和决定,根据Aufbau原理,电子首先进入能量相对较低的轨道,然后进入能量较高的轨道。
Chris Evans, Dr. Roger Peters, Dr. Mike Thompson, Chris Gadsby, Ken Partridge, Roy Mylan, Yehoshua Sivan, Tom Nation, Dr. David Follows, Vikash Hemnath Seeboo, Aufbau, CC0 1.0
泡利不相容原理
根据该原理,原子轨道中只能容纳自旋相反的电子对,并且同一原子中没有两个电子的所有四个量子数都相同。
如果两个电子具有相同的主量子数、角量子数和磁量子数,则它们应该具有相反的自旋。
洪特规则
在将第二个电子放置在轨道中之前,特定亚层中的每个轨道都应单独填充电子。
原子电子构型的表示
在本节中,给出了几个元素电子构型的示例。
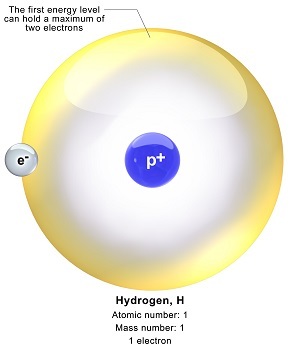
氢的电子构型
H的原子序数为1。因此,H原子具有1个电子,该电子将被分配到第一层/s轨道的亚层。H的电子构型为1s1。
BruceBlaus, Blausen 0529 HydrogenAtom, CC BY 3.0
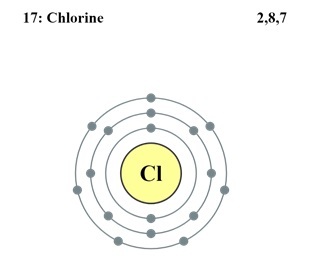
氯的电子构型
Cl的原子序数为17。因此,其17个电子分布如下:
K层2个电子
L层8个电子
M层7个电子
以下是Cl的电子构型,可以表示为$\mathrm{1s^2 2s^2 2p^6 3s^2 3p^5}$。
Pumbaa (original work by Greg Robson), Electron shell 017 Chlorine, CC BY-SA 2.0 UK
结论
可以得出结论,电子构型是元素原子壳层内电子分布的描述。该构型有助于确定这些电子的位置,因为这些电子在数学上位于这些亚层中。根据它们的电子构型,元素周期表将元素分为四类。这些由s、p、d和f区元素组成。主量子数决定了壳层中可以容纳的电子最大数量(n)。电子在亚层中的分布由角量子数决定,用字母“l”表示。
常见问题
1. 电子构型规则的例外情况有哪些?
铬和铜是电子构型规则的两个主要例外。在这些情况下,完全或半填充的d亚层电子构型比仅部分填充的电子构型更稳定,这导致来自4s轨道的激发电子跃迁到3d轨道。
2. 在n=3能级,哪些亚层是可能的?在这个能级上,有多少轨道是可能的?
我们知道亚层的数量取决于角量子数。给定n=3,l的值为0、1和2。因此,在n=3能级,有3个亚层——s、p和d是可能的。
对于n=3能级,我们有3个亚层——s、p和d亚层。据我们所知,s亚层有一个轨道,p有三个轨道,而d亚层有五个。因此,n=3能级总共有九个轨道。
3. 元素具有特定的电子构型为什么很重要?
通过识别原子的价电子,电子构型可以阐明其化学行为。此外,它有助于将元素组织到不同的区域,如s、p、d和f区。
4. 列出电子构型的重要性。
重要性如下:
它们有助于确定原子的反应性状态。
它有助于识别其化学和物理特性。
它预测原子的磁性。
5. n=3有哪些亚层?
一个轨道最多可以容纳2个电子,对于n=3,存在4个亚层——s、p、d和f。对应于s、p、d和f亚层的轨道最大数量分别为1、3、5和7。


 数据结构
数据结构 网络
网络 关系数据库管理系统 (RDBMS)
关系数据库管理系统 (RDBMS) 操作系统
操作系统 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C语言编程
C语言编程 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP