电子亲和力
简介
电子亲和力是原子能量的变化。当一个中性原子在其外层增加电子时,它会释放能量并带负电荷。元素获得电子以稳定其八隅体。
元素接受或失去电子时会释放能量。在化学反应中,当元素接受电子形成化合物时,它会释放能量,这称为放热反应。释放能量以吸引来自另一个元素的原子核的电子,这就是为什么在放热反应中会释放能量的原因。当元素失去电子时,它会吸收能量,这被称为吸热过程。当原子失去电子时,原子会获得能量。
什么是电子亲和力?
在化学反应中,分子会释放或获得能量。这种能量的释放和获得是通过获得或失去电子来实现的。接受电子的原子会释放能量,这些反应被称为放热反应。另一方面,在化学反应中失去电子的原子会吸收能量,被称为吸热反应。电子的亲和力是接受电子的能力。当一个中性的气态原子接受电子时,它将带负电荷形成负离子。第一电子亲和力总是负的,第二电子亲和力总是正的。很难测量原子的电子亲和力。它是通过测量离子化合物的能量释放来测量的。电子亲和力也通过原子作为氧化剂或还原剂的趋势来衡量。它以千焦/摩尔为单位测量。电子亲和力用 Ea 表示。

第一电子亲和力
当一个中性原子接受一个电子时,能量被释放,原子获得负电荷。第一电子亲和力总是负的,因为原子核需要更多的能量来吸引电子。
$$\mathrm{X(g)\:+\:e\:\rightarrow\:X(g)}$$
元素周期表中 16 族和 17 族元素表现出最佳的电子亲和力。这些非金属元素比释放电子来完成其八隅体更有能力从其他元素中接受电子。
示例 - 氟原子和氯原子中第一个电子的电子亲和力分别为 -328 kJ/Mol 和 -349 KJ/Mol。金属的电子亲和力较低,因为金属更容易失去外层电子而不是获得电子。金属对其外层电子的吸引力较小,失去电子是一个吸热过程。下表列出了金属和非金属的电子亲和力。
金属的电子亲和力较低,因为金属更容易失去外层电子而不是获得电子。金属对其外层电子的吸引力较小,失去电子是一个吸热过程。下表列出了金属和非金属的电子亲和力。
| 金属 | 电子亲和力 | 非金属 | 电子亲和力 |
|---|---|---|---|
| 𝐿𝑖 | -60 KJ/Mol | F | -328 KJ/ Mol |
| 𝑁𝑎 | -53 KJ/Mol | Cl | -349 KJ/ Mol |
| K | - 48 KJ/Mol | Br | -324 KJ/ Mol |
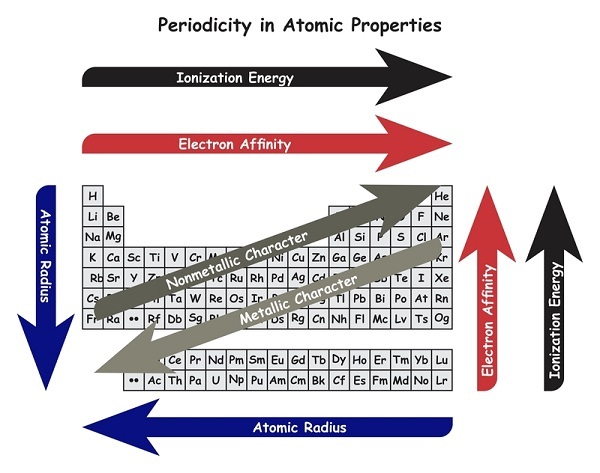
当我们在元素周期表中向下移动一个族时,电子亲和力降低。
当我们在元素周期表中从左向右移动一个周期时,电子亲和力增加。
金属通过失去电子形成阳离子。
非金属通过接受电子形成阴离子。
第二电子亲和力
电子亲和力在 16 族元素(如氧、硫和硒)中可见。向带负电荷的元素(阴离子)添加电子所需的能量。这些形成 (-2) 离子的元素被称为第二电子亲和力。
向 1 摩尔 (-1) 气态离子添加电子以形成 1 摩尔带 -2 电荷的气态离子所需的能量。
$$\mathrm{X(g)\:+\:e\:\rightarrow\:X^{-2}(g)}$$
示例 -
我们可以通过硫离子的例子来理解,
$$\mathrm{S(g)\:+\:e\:\rightarrow\:S^{-2}(g)}$$
$$\mathrm{S^{-1}(g)\:+\:e\:\rightarrow\:S^{-2}(g)}$$
方程式中硫的电子亲和力为 -200 kJ/Mol。
在氧气中,电子亲和力 -
$$\mathrm{O(g)\:+\:e\:\rightarrow\:O^{-1}(g)\:EA\:=\:142KJ/Mol}$$
$$\mathrm{O^{-1}(g)\:+\:e\:\rightarrow\:O^{-2}(g)\:EA\:=\:+844KJ/Mol}$$
由于氧负离子中的电子-电子排斥,氧分子中的第二电子亲和力高于第一电子亲和力。
影响电子亲和力的因素
有一些因素会影响分子的电子亲和力,这些因素是元素的原子大小、分子上的核电荷以及原子的电子构型。
原子大小的影响 - 与原子尺寸较大的原子相比,原子尺寸较小的原子具有更大的电子亲和力。较小原子的原子核对电子的吸引力比较大原子强。随着原子尺寸的增加,外层电子远离原子核,对电子外层电子的吸引力也会降低。
示例 - Br 的电子亲和力高于 I,分别为 -324 KJ/Mol 和 -285 KJ/Mol。
核电荷 - 核电荷也会影响电子亲和力。随着原子电荷的增加,对电子的吸引力也增加,因此电子亲和力也增加。如果分子已经带电,则电子排斥力增加,原子核的吸引力也增加,因此带电离子的电子亲和力也增加。
示例 - 氧的第一次反应的电子亲和力低于第二次电子亲和力。
屏蔽效应 - 当我们降低原子内层的屏蔽效应时,电子亲和力会增加。
$$\mathrm{电子亲和力\:=\:\frac{1}{屏蔽效应}}$$
电子构型 - 电子构型也会影响电子亲和力。具有完整八隅体的元素几乎没有接受电子的趋势,因此惰性气体的电子亲和力为零。电子构型在电子亲和力中起着至关重要的作用。由于金属的电子构型,金属对电子的亲和力低于非金属。
$$\mathrm{O(g)\:+\:e\:\rightarrow\:O^{-1}(g)\:EA\:=\:142KJ/Mol}$$
$$\mathrm{O^{-1}(g)\:+\:e\:\rightarrow\:O^{-2}(g)\:EA\:=\:+844KJ/Mol}$$
结论
电子亲和力是在气态形式下接受电子并形成阴离子的能力。接受电子会释放能量,因此称为放热过程。当我们在族中从上到下移动时,电子亲和力降低,当我们在周期中从左到右移动时,电子亲和力增加。它用符号 EA 表示,并以千焦/摩尔 (KJ/Mol) 为单位测量。由于电子-电子排斥,第一电子亲和力始终小于第二电子亲和力。电子亲和力受元素的原子大小、电子构型、屏蔽效应和核电荷的影响。
常见问题解答
1. 为什么氟的电子亲和力低于氯?
氟分子的原子尺寸小于氯分子,氟的外层电子已经充满,原子核非常靠近外层电子,因此当我们在氟分子外层添加电子时,电子排斥力高于原子核的吸引力,与氯分子相比。
2. 为什么硫分子的电子亲和力高于氧分子?
当我们向下移动一个族时,分子的原子尺寸增加,电子亲和力也降低,但硫是一个例外,因为硫的电子亲和力为 -200 KJ/Mol,高于氧分子的 -142KJ/Mol。由于硫的尺寸较小,外层电子拥挤,原子核靠近外层电子,因此电子排斥力高于原子核的吸引力,这就是为什么硫的电子亲和力高于氧的原因。
3. 电子亲和力是正的还是负的?
当电子被添加到元素中时,它是负的,因此最初的电子亲和力是负的,但是当我们将电子添加到负离子时,它可能是正的或负的,这取决于电子排斥力。
4. 为什么惰性气体的电子亲和力为零?
惰性气体的电子亲和力为零,因为惰性气体的八隅体是完整的,它们对电子没有亲和力。这就是为什么惰性气体的电子亲和力为零。
5. 为什么 17 族表现出高电子亲和力?
卤素族的元素具有较高的电子亲和力,因为卤素的尺寸较小,外层电子较多。为了完成其八隅体,卤素更容易接受一个电子而不是失去七个电子。


 数据结构
数据结构 网络
网络 关系型数据库管理系统
关系型数据库管理系统 操作系统
操作系统 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C 编程
C 编程 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP