休克尔规则
简介
德国化学家和物理学家埃里希·休克尔于1931年确定了休克尔规则。他提出芳香环遵循四个准则才能成为芳香族化合物。第一个是它应该是环状的,第二个是它应该是平面的,第三个是它应该具有共轭结构,第四个是它必须遵循休克尔规则。芳香族化合物具有$\mathrm{4n\:+\:2\:pi\:electrons}$。公式中的n是一个正整数。芳香族化合物具有$\mathrm{sp^{2}\:hybrodization}$。
什么是休克尔规则?
休克尔规则是一种算法,它结合了芳香环中π电子的数量,并确定环是芳香族还是非芳香族。它由公式4n+2定义。如果得到的N值为整数,则符合条件。除此之外,化合物必须满足以下标准才能成为芳香族化合物。
芳香族化合物必须是环状的。
该化合物应该是平面型的,这意味着它具有$\mathrm{sp^{2}}$杂化。
该化合物具有共轭结构,意味着π电子可以在整个环上发生共振,使其具有共轭性。
第四,它必须遵循休克尔的芳香性规则。
| 芳香族化合物 | 休克尔规则 (4𝑛 + 2) |
| 非芳香族化合物 | 莫比乌斯体系 (𝟒𝒏) |
对芳香族化合物的贡献
并非所有环状、平面和共轭的化合物都稳定且芳香。化合物中的芳香性使其更加稳定。我们可以通过环丁二烯和苯环的例子来更好地理解这一点。
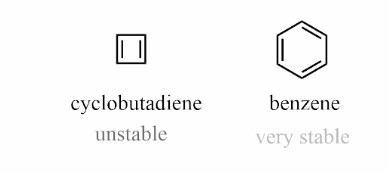
在环丁二烯中,它是环状的、平面的和共轭的,但由于不遵循休克尔规则而不稳定。在环丁二烯中,它总共有4个π电子。
$$\mathrm{4n\:+\:2\:=\:=\:4}$$
$$\mathrm{4n\:=\:4\:-\:2}$$
$$\mathrm{n\:=\:\frac{2}{4}}$$
$\mathrm{n\:=\:\frac{1}{2}}$ 它是一个分数值,
因此,它不遵循休克尔规则,并且高度不稳定,它是反芳香族的。
在苯环中,它是环状的、平面的、共轭的,让我们检查它是否遵循休克尔规则。它有6个π电子。
$$\mathrm{4n\:+\:2\:=\:6}$$
$$\mathrm{4n\:=\:6\:-\:2}$$
$$\mathrm{4n\:=\:4}$$
$$\mathrm{n\:=\:\frac{4}{4}}$$
n=1,n的值是整数,这意味着它遵循休克尔规则并且是稳定的化合物。
为什么是4n+2个电子?
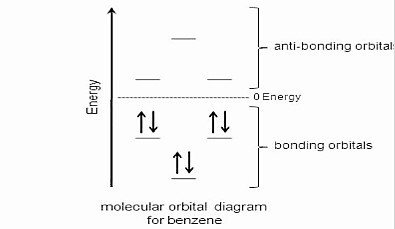
根据休克尔的轨道理论,当轨道中存在的电子配对时,化合物是稳定的。芳香族化合物比反芳香族或非芳香族化合物更稳定。芳香族化合物遵循休克尔规则,并且在它们的轨道中具有4n个π电子。
在苯中,有6个π电子,具有sp2杂化。s轨道中的前两个电子处于最低能级,其余4个π电子处于p轨道中。它们处于更高的能级。
所有电子都位于成键轨道中,没有一个位于反键轨道中。
休克尔规则在苯环中的应用。
$$\mathrm{4n\:+\:2\:=\:6}$$
$$\mathrm{4n\:=\:6\:-\:2}$$
$$\mathrm{4n\:=\:4}$$
$$\mathrm{n\:=\:\frac{4}{4}}$$
$$\mathrm{n\:=\:1}$$
1是一个整数,遵循休克尔规则。
如果一个化合物具有奇数个电子对,即(1、3、5、7、9、11…等),我们也可以判断该化合物是否为芳香族。
如果一个化合物在轨道中具有2、6、10、14和18个电子,则它遵循休克尔规则。
休克尔规则的一些例子
萘中的芳香性
萘分子
在萘分子中,电子数为10个π电子。它是环状的、平面的和共轭的。我们必须通过4n+2公式进行检查。
$$\mathrm{4n\:+\:2\:=\:10}$$
$$\mathrm{4n\:=\:10\:-\:2}$$
$$\mathrm{4n\:=\:8}$$
$$\mathrm{n\:=\:\frac{8}{4}}$$
$$\mathrm{n\:=\:2}$$
n的值为2,这是一个整数,这意味着萘遵循休克尔规则并且是芳香族的。
戊烯中的芳香性
戊烯
也是一种环状化合物,平面且具有sp2杂化的共轭结构,并且具有8个π电子。
$$\mathrm{4n\:+\:2\:=\:8}$$
$$\mathrm{4n\:=\:8\:-\:2}$$
$$\mathrm{4n\:=\:6}$$
$$\mathrm{n\:=\:\frac{6}{4}}$$
$$\mathrm{n\:=\:\frac{3}{2}}$$
我们已经计算了该值,发现n的值为3/2,这是一个分数。即使它满足芳香性的所有其他标准,但它不遵循休克尔规则。因此,它不是芳香族的。
休克尔规则的应用
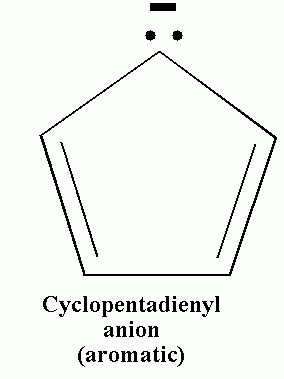
休克尔规则帮助我们找到单环烃化合物的稳定性。在环戊二烯负离子𝐶5𝐻5−中,它有6个π电子,并且遵循休克尔规则。因此,它是一种稳定的化合物。
它帮助我们通过𝑡ℎ𝑒 $\mathrm{4n\:+\:2}$规则来定义化合物是芳香族还是非芳香族。
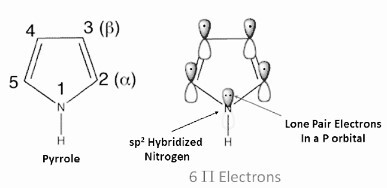
一些化合物的阳离子和阴离子遵循休克尔规则。它们可以表现出不同的稳定性。吡咯就是一个这样的例子,它有4个电子和一对孤对电子,它们有助于π键的形成。我们得到6个π电子,它们遵循休克尔规则。因此,吡咯是一种芳香族化合物。
在环戊二烯负离子中,有6个π电子。4个电子来自两个π键,一对来自阴离子。π电子的总数为6,遵循休克尔规则。因此,它是一种芳香族化合物。
休克尔规则的例外
休克尔规则有一些例外。
平面化合物不是很稳定,但环丁二烯𝐶4𝐻4是一种平面、环状和非芳香族化合物,但在低于35开尔文温度下是稳定的。
另一个例外是多环化合物芘,它是一种芳香族化合物,但不遵循休克尔规则。
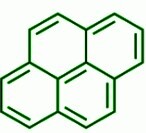
芘
还有一个例外是反式双环戊二烯,它是一种具有8个π电子的芳香族环状化合物,但不遵循休克尔规则。
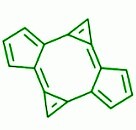
反式双环戊二烯
结论
在本教程中,我们学习了休克尔规则,它帮助我们找出化合物是芳香族还是非芳香族。遵循四个标准的环状化合物,即它是平面的,具有$\mathrm{sp^{2}}$杂化,并且其电子在整个环中发生共振,它是环状的并且遵循休克尔规则4𝑛 + 2,是一种芳香族化合物,但也有一些例外,如芘、反式双环戊二烯,它们是芳香族但并不遵循休克尔规则。它帮助我们找出化合物的稳定性。
常见问题
1. 什么是反芳香族化合物?
它遵循4n莫比乌斯体系。它们是环状的、平面的和共轭的,但高度不稳定。例如:环丁二烯,它具有4个π电子。
2. 解释为什么环戊二烯负离子是芳香族化合物?
环戊二烯负离子是一种环状、平面化合物,具有孤对电子,碳的负电荷形成$\mathrm{sp^{3}}$杂化,为了稳定芳香环,它转变为$\mathrm{sp^{2}}$杂化,并且孤对电子在环上离域。
3. 为什么环丙烯基阳离子是芳香族的?
环丙烯基阳离子是一种环状化合物,并且具有$\mathrm{sp^{2}}$杂化。它具有三个碳原子和2个π电子。环丙烯基的阳离子具有平行和平面的p轨道,并满足芳香族化合物的所有标准。
4. 什么是芳香族化合物?
芳香族化合物是具有σ键和环碳之间离域π电子的烃。
5. 芳香族化合物的用途是什么?
芳香族化合物高度稳定,用于药物、杀虫剂、燃料形成、油漆、洗涤剂等。


 数据结构
数据结构 网络
网络 关系型数据库管理系统
关系型数据库管理系统 操作系统
操作系统 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C 语言编程
C 语言编程 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP