理想解
引言
溶液是由不同类型的化合物混合而成的。主要是溶质在溶剂中的**溶解**作用。溶液有两种类型:**均相溶液和非均相溶液**。**溶液**的性质均匀的是均相溶液。
而性质不均匀的则为**非均相溶液**。许多定律与溶液有关。拉乌尔定律就是这样一种定律。法国化学家弗朗索瓦-玛丽·拉乌尔在1880年发现了**拉乌尔定律**,用于解释理想溶液。该定律主要关注理想溶液的性质。但它也适用于一些非常稀的溶液。
什么是理想溶液?
物质的混合物是溶液。理想溶液是拉乌尔定律在较宽浓度范围内成立的均相混合物。**理想溶液**的物理性质与纯物质(如溶质和溶剂)的性质呈线性关系。不同组分不同分子之间的相互作用与相同组分分子之间的相互作用相同。这意味着溶质和溶剂分子之间没有特殊的反应或**相互作用**。这类似于理想气体分子,这就是它被称为理想溶液的原因。但与**理想气体**分子不同的是,理想溶液中存在的分子之间会施加一定的力。当这些力相等时,该溶液就被认为是理想的。
溶液是由具有几乎相同分子量和相同分子间力的物质混合而成的。即使形成了溶液,每个分子也很容易区分。对于这种溶液,溶液的焓值为零,即$\mathrm{\Delta\:H_{solution}\:=\:0}$。理想溶液可以通过溶解具有几乎相同分子量的两种物质来制备。例如,甲苯和苯的混合物将形成理想溶液,这是因为它们的分子量相似。

理想溶液的特性
理想溶液的特性非常独特,这也是理想溶液非常重要的原因。下面指出了理想溶液的一些特性行为。
要形成溶液,必须有两种不同的化合物,例如X和Y。这两种化合物的溶解将导致某种**分子间力**。它们是$\mathrm{X\:-\:X\:,\:Y\:-\:Y,\:and\:X\:-\:Y}$相互作用。对于理想溶液,两种化合物之间的所有相互作用都是相同的。
理想溶液的热力学量,例如$\mathrm{\Delta\:_{mix}H\:=\:0\:and\:\Delta\:_{min}V\:=\:0}$。
用于制备理想溶液的化合物必须具有相似的**分子量和结构**。
分离理想溶液中存在的各个组分不需要任何复杂的过程,**简单的分馏**即可用于分离。
在整个**浓度**范围内,理想溶液都服从拉乌尔定律。
什么是拉乌尔定律以及如何推导?
拉乌尔定律处理溶剂的分压。根据拉乌尔定律,溶液的分压等于真实溶剂的**蒸气压**与其所形成溶液的摩尔分数的**乘积**。用数学方法可以表示为:
$$\mathrm{P_{solution}\:=\:X_{solvent}\:P_{solvent}^{0}}$$
其中,
$\mathrm{X_{solvent}\:=\:溶剂摩尔分数}$
$\mathrm{P_{solution}\:=\:溶液蒸气压}$
$$\mathrm{P_{solvents}^{0}\:=\:纯溶剂蒸气压}$$
对于由A和B溶解而成的混合物,拉乌尔定律的方程变为:
$$\mathrm{P_{A}\:=\:X_{A}\:P_{A}^{0}}$$
$$\mathrm{P_{B}\:=\:X_{B}\:P_{B}^{0}}$$
与溶液相关的总蒸气压可以计算为:
$$\mathrm{P_{r}\:=\:X_{A}\:P_{A}^{0}\:+\:X_{B}\:P_{B}^{0}}$$
这样,就可以利用拉乌尔定律计算总蒸气压。
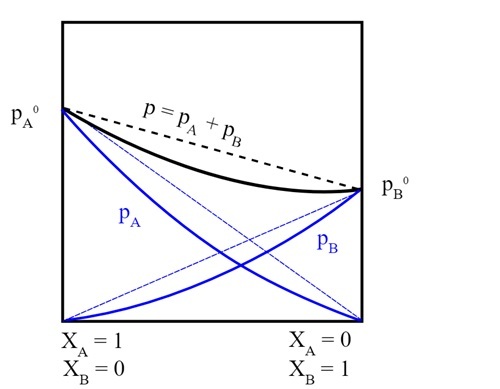
AngelVelOre, 真实溶液蒸气压, CC BY-SA 4.0
拉乌尔定律的重要性是什么?
该定律有很多重要的方面。下面解释了拉乌尔定律的一些重要性
拉乌尔定律解释了**理想溶液**。
拉乌尔定律还解释了混合物的蒸气压总是小于**真实溶剂**的蒸气压。
利用拉乌尔定律还可以解释与**非挥发性溶质**相关的蒸气压。
拉乌尔定律解释了所有固体和液体化合物都具有蒸气压。
拉乌尔定律解释了液体和蒸气粒子之间的动态平衡。
理想溶液的性质
下面几点解释了理想溶液的一些性质。
混合形成理想溶液的组分时,焓不会发生任何变化。
理想溶液中分子之间存在的相互作用与单个分子相互作用相同。这意味着溶质-溶质和溶质-溶剂相互作用是相同的。
理想溶液中各组分的活度等于摩尔分数。
溶剂的性质仅依赖于**溶质**粒子的浓度。
在理想溶液的情况下,**分子间力**不为零,但所有类型的相互作用都是相同的。
结论
理想溶液是一种不同于普通溶液的溶液。由于存在具有几乎相同**结构和分子量**的组分,它们在某些行为上表现出理想性。理想溶液表现出的特性是不同的。理想溶液组分之间存在的相互作用是相同的。
对于**理想溶液B**,溶解两种不同的**组分**后,溶液的焓不会发生任何变化。形成理想溶液后,溶解两种组分后的体积变化为零。拉乌尔定律的理想溶液处理的是混合物的**蒸气压**。甲苯和苯的混合物是理想溶液的一个例子,它符合理想溶液的所有标准。
常见问题
1. 举例说明一些理想溶液?
一些例子是正庚烷和正己烷、氯苯和溴苯、溴乙烷和碘乙烷等
2. 什么是非理想溶液?
不服从理想溶液任何标准的溶液是非理想溶液。非理想溶液中存在的组分之间的分子间力并不相同。而且,非理想溶液也不遵循拉乌尔定律。
3. 举例说明一个非理想溶液?
非理想溶液有很多例子,与理想溶液相比,生产非理想溶液并不是一个复杂的过程。非理想溶液的一个例子是丙酮和氯仿的混合物。
4. 什么是理想气体?
这是一个假设的概念,其中理想类型的汽体分子没有任何相互作用,只参与弹性碰撞。它们与真实气体的性质不同。
5. 什么是亨利定律?
该定律关注气体在液体中的溶解。溶解在液体中的气体的重量与气体对液体的压力相似。该定律仅解释稀溶液和低压气体。因此,特定气体的溶解度与其压力呈线性关系。


 数据结构
数据结构 网络
网络 关系数据库管理系统 (RDBMS)
关系数据库管理系统 (RDBMS) 操作系统
操作系统 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C语言编程
C语言编程 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP