(a) 写出钠原子和氯原子的电子排布式。(b) 钠原子和氯原子的最外层各有几个电子?
(c) 通过电子转移,说明NaCl由钠原子和氯原子形成的过程。
(d) 为什么氯化钠的熔点很高?
(e) 电解精炼不纯铜时,阳极和阴极分别是什么?
(a) 下列原子的电子排布式为:
(i) 钠 – 2, 8, 1
(ii) 氯 – 2, 8, 7
(b) 最外层电子数:
(i) 钠 = 1
(ii) 氯 = 7
(c) 钠原子和氯原子通过电子转移形成NaCl的过程如下图所示: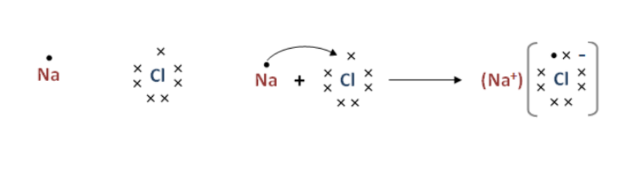

(d) 氯化钠的熔点很高,因为它是一种离子化合物。离子化合物由带电的离子组成,可以是正离子(阳离子)或负离子(阴离子)。离子间的吸引力非常强,难以破坏。因此,需要大量的能量才能破坏这些键。
(e) 铜的电解精炼过程中:
阳极: 厚块的不纯铜金属
阴极: 薄片纯铜金属。

广告

 数据结构
数据结构 网络
网络 关系数据库管理系统(RDBMS)
关系数据库管理系统(RDBMS) 操作系统
操作系统 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C语言编程
C语言编程 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP