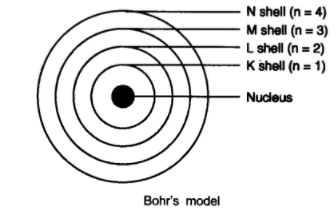
描述玻尔的原子模型。
玻尔的原子模型
(1) 原子中心有一个原子核。
(2) 电子围绕原子核旋转。
(3) 原子内部允许存在某些特殊的轨道,称为电子的离散轨道。
(4) 电子在离散轨道上旋转时不辐射能量。
(5) 这些轨道或壳层称为能级。
(6) 这些轨道或壳层用字母 K、L、M、N 或数字 n = 1、2、3、4 表示。
[额外信息: 玻尔的原子模型由尼尔斯·玻尔于 1915 年提出。玻尔原子模型的假设如下
- 在原子中,电子(带负电)围绕带正电的原子核在称为轨道或壳层的特定路径上旋转。每个轨道或壳层都具有固定的能量,这些圆形轨道被称为轨道壳层。
- 能级用整数 (n=1、2、3…) 表示,称为量子数。该量子数范围从原子核到侧面,n=1 具有最低能级。轨道 n=1、2、3、4… 分别指定为 K、L、M、N… 壳层,当电子达到最低能级时,据说处于基态。
- 原子中的电子通过获得所需的能量从较低能级跃迁到较高能级,而电子通过损失能量从较高能级跃迁到较低能级。
- 电子只能在角动量量子化的轨道上运动,即电子的角动量是 h/2π 的整数倍。]

广告

 数据结构
数据结构 网络
网络 关系数据库管理系统
关系数据库管理系统 操作系统
操作系统 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C 编程
C 编程 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP