- 说明通过结合原子之间电子转移形成Na2O的过程。
- 为什么离子化合物通常很硬?
- 固态离子化合物不导电,但熔融状态下却导电,这是为什么?
- CCl4中存在什么类型的化学键?
- MgCl2中存在什么类型的化学键?
(a) 钠的电子构型:2,8,1;氧的电子构型:2,6。因此,两个钠原子各捐出一个电子给氧原子,得到稳定的2[Na+],而氧原子通过获得两个电子变得稳定,形成O2-。
通过结合原子之间电子转移形成Na2O的过程如下所示
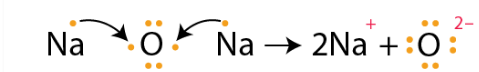
(b) 离子化合物通常很硬,因为它们具有相互强烈吸引的带相反电荷的离子,并形成晶体结构。
(c) 固态离子化合物由离子构成,但不导电,因为它们被强大的静电引力束缚在一起,限制了离子的运动。在熔融状态下,晶体结构被破坏,离子可以自由移动。 因此,它可以导电。
(d) 四氯化碳 (CCl4) 中存在 4 个共价键。
(e) MgCl2 中存在离子键,其中一个Mg原子将2个电子捐献给2个氯原子,变得稳定。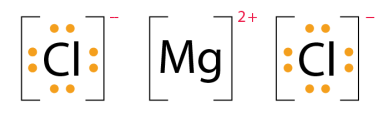

广告

 数据结构
数据结构 网络
网络 关系数据库管理系统 (RDBMS)
关系数据库管理系统 (RDBMS) 操作系统
操作系统 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C语言编程
C语言编程 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP