道尔顿分压定律
介绍
根据气体动理论,气体扩散以充满容器中占据的空间,因为它没有分子间相互作用。换句话说,气体混合物中的粒子间隔足够大,可以独立于彼此而不会相互作用。由于没有与其他物质粒子的相互作用,因此理想气体的压力是由其与容器的相互作用决定的,而不是由其与其他物质粒子的相互作用决定的。在不改变另一种气体压力的前提下,气体会膨胀以充满其所封闭的容器。因此,可以说气体的压力取决于其分子量、体积和温度。混合物中不同气体的温度 (T) 和体积 (V) 是相同的,因为它们都包含在同一个容器中。容器中所含气体的总压力可以通过将每种气体在系统中产生的压力加起来计算。
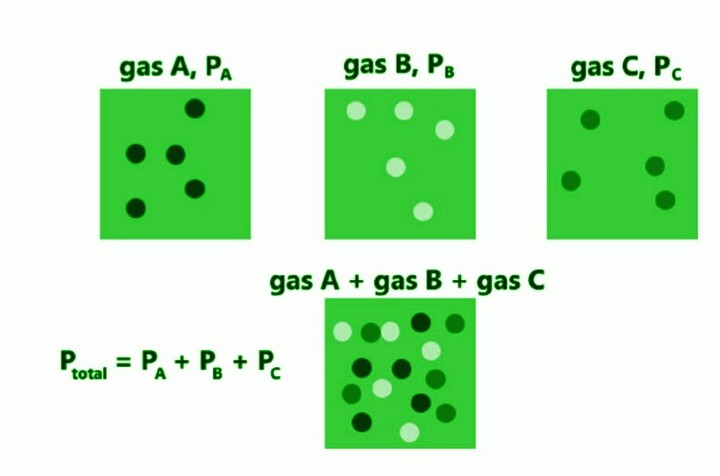
BlyumJ,描述道尔顿定律的示意图,CC BY-SA 4.0
什么是分压?
特定气体在其他气体混合物中施加的压力称为该特定气体的分压。例如,如果一个容器包含3种气体的混合物——氧气、氮气和CO₂——则其分压等于氧气对容器壁施加的压力,其分压等于氮气和二氧化碳的分压。混合物中O₂、N₂和CO₂的分压之和对容器壁施加总压力。
换句话说,构成气体混合物的每种气体都有一个分压。这表示如果该气体充满初始混合物,则在相同温度下的假设压力。
气体的分压衡量其热力学活性。气体的分压可以揭示其多种特性。例如,气体的分压会影响其在特定体积中的反应活性。即使是气体的分压也决定了它们的溶解和扩散方式。气体的这一特性有助于我们理解和预测气体在生物学中的化学过程。O₂和CO₂的分压是动脉血气分析的重要因素。
带有下标中气体符号的符号P代表气体的分压。例如,PO₂表示O₂的分压。

什么是道尔顿分压定律?
英国科学家、物理学家和气象学家约翰·道尔顿于1802年制定并首次发表了分压定律。道尔顿分压方程指出,气体混合物的总压力等于组成气体分压之和。道尔顿定律对于理想气体混合物是精确的。因为它们距离相对较远,理想气体中的分子不能相互作用。真实的混合气体在很大程度上遵循道尔顿定律。
例如,包含氮气、氢气和氧气的理想气体混合物将产生以下总压力
$$\mathrm{P_{total}\:=\:P_{N_{2}}\:+\:P_{H_{2}}\:+\:P_{O_{2}}}$$
在这种情况下−
$\mathrm{P_{total}\:=\:理想气体混合物的总压力}$
$\mathrm{P_{N_{2}}\:=\:氮气的分压}$
$\mathrm{P_{H_{2}}\:=\:氢气的分压}$
$\mathrm{P_{O_{2}}\:=\:氧气的分压}$
让我们来看一个额外的例子。氮气和氧气的混合气体被放置在一个烧杯中。
如果O₂和N₂的分压分别为148 mm Hg和590 mm Hg,则混合气体产生的总压力将为148 mm Hg + 590 mm Hg = 738 mm Hg。
摩尔分数和分压
为了理解摩尔分数和分压之间的关系,我们首先必须对摩尔分数有一个基本的了解。摩尔分数是混合物中一种气体成分与所有其他气体成分之和的比例。它用𝑥𝑖表示。
摩尔分数公式−
$$\mathrm{x_{i}\:=\:\frac{n_{i}}{n_{total}}}$$
$\mathrm{x_{i}\:=\:摩尔分数}$
$\mathrm{n_{i}\:=\:构成混合物的特定气体的摩尔数}$
$\mathrm{n_{total}\:=\:混合物中每种成分的摩尔数之和。摩尔分数也称为组分分数。}$
摩尔分数和分压之间的关系
理想气体混合物中某种气体成分的摩尔分数可以表示为-
$$\mathrm{x_{i}\:=\:\frac{n_{i}}{n}\:............(1)}$$
其中𝑛𝑖是由每种气体组成的理想气体混合物的总摩尔数。n是理想气体混合物中所有成分的摩尔数之和。
$\mathrm{摩尔分数\:=\:x_{i}}$
另一种表达理想气体混合物中某种气体的摩尔分数的方法如下−
$$\mathrm{x_{i}\:=\:\frac{p_{i}}{p}..........(2)}$$
其中𝑃𝑖是理想气体混合物中每种气体单独的最佳分压。P是最佳气体混合物的总压力。
$\mathrm{摩尔分数\:=\:x_{i}}$
方程(1)和(2)允许我们写出-
$$\mathrm{x_{i}\:=\:\frac{n_{i}}{n}\:=\:\frac{p_{i}}{p}}$$
因此,理想气体混合物中特定气体的分压可以表示为
$$\mathrm{P_{i}\:=\:x_{i}\:.\:p}$$
鉴于气体混合物中气体成分的体积分数与其摩尔分数相似,我们可以写出-
$$\mathrm{\frac{P_{X}}{P_{total}}\:=\:\frac{V_{X}}{V_{total}}\:\frac{n_{x}}{n_{total}}}$$
其中𝑛𝑋=气体成分X的摩尔数
𝑛𝑡𝑜𝑡𝑎𝑙 =混合物所有成分的总摩尔数。
𝑃𝑋 =X的气体分压。
𝑃𝑡𝑜𝑡𝑎𝑙是整个气体混合物的压力。
𝑉𝑋 =任何给定气体成分X的分压。
𝑉𝑡𝑜𝑡𝑎𝑙=混合物的总体积
结论
总之,我们可以说气体混合物的总压力等于每种气体施加的分压之和。因此,借助道尔顿定律,我们可以计算每种气体的分压。但条件是气体必须是非反应性的。
混合物的总压力−
$$\mathrm{P_{total}\:=\:P_{gas\:1}\:+\:P_{gas\:2}\:+\:P_{gas\:3}}$$
道尔顿定律也可以用气体的摩尔分数表示为:
$$\mathrm{P_{gas\:1}\:=\:x_{1}P_{total}}$$
常见问题
1. 道尔顿分压定律的限制是什么?
在低压下,该定律对实际气体有效,但在高压下会发生显著偏差。气体混合物不以任何方式发生反应。还认为每种单个气体的分子之间的相互作用与混合物中粒子之间的相互作用相同。
2. 哪种情况会排除道尔顿定律的使用?
由于NH₃和HCl是反应性气体,因此道尔顿分压定律不适用于它们,该定律仅适用于非反应性气体。
3. 为什么道尔顿分压定律不适用于反应性气体?
道尔顿定律仅适用于非反应性气体的混合物,这意味着气体不发生化学反应,并且只有在这种情况下,每种气体的分压之和才等于混合物的总压力。道尔顿定律不适用于由反应性气体组成的反应混合物,因为在这种情况下,气体将没有独立的蒸汽压,因此道尔顿定律将不适用于这些情况。
4. 道尔顿原子理论的主要论点是什么?
根据他的理论的第一部分,原子——不可分割的——构成所有物质。理论的第二部分指出,特定元素中每个原子的质量和特性都是相同的。根据第三部分,化合物是由两种或多种不同类型的原子结合而成的。
5. Kp和Kc——它们是什么?
理想气体混合物的平衡常数为Kp和Kc。当平衡浓度用大气压表示时,使用的平衡常数为Kp;当用摩尔浓度表示时,为Kc。


 数据结构
数据结构 网络
网络 关系数据库管理系统 (RDBMS)
关系数据库管理系统 (RDBMS) 操作系统
操作系统 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C语言编程
C语言编程 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP