亨利定律
简介
亨利定律是重要的气体定律之一,由英国医生和化学家威廉·亨利于1830年提出,以此命名以示敬意。该定律仅适用于稀溶液。该定律与其他理论相结合,在化学领域得到了广泛应用。该定律关注特定体积下气体在特定液体中的溶解。它将涉及溶解在液体中的气体的重量。它描述了溶解气体与分压之间的关系。根据该定律,在恒温下,它们成正比。
什么是亨利定律?
亨利定律是一个气体定律,因为它涉及气体的性质。在恒温下,对于一定体积的液体,溶解在其中的气体量与液体上方气体的分压成正比。这意味着气体和液体处于平衡状态。溶解的气体意味着它涉及气体在液体中的溶解度。该定律可以用数学公式表示为:
$$\mathrm{C\alpha\:P_{gas}}$$
$$\mathrm{C\:=\:KP_{gas}}$$
其中:
$\mathrm{C\:=\:气体的溶解度(ml,gas/L)}$
$\mathrm{K\:=\:亨利常数\:(M/atm)}$
$\mathrm{P_{gas}\:=\:气体的分压(atm)}$
亨利定律还指出,任何气体的分压都直接等于其摩尔分数。因此,我们可以给出亨利定律的另一个数学公式:
$$\mathrm{P_{gas\:\varpropto\:X}}$$
$$\mathrm{P_{gas}\:=\:KX}$$
其中:
$\mathrm{X\:=\:摩尔分数}$
什么是摩尔分数?
摩尔分数或物质分数涉及溶液。它是溶液中溶质的摩尔数除以溶液中存在的总摩尔数。即:
$$\mathrm{摩尔分数\:=\:溶质的摩尔数\:/\:溶液中存在的总摩尔数}$$
摩尔分数和分压之间的关系可以用图表表示为:
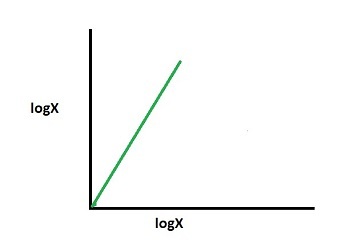
当压力恒定时?
当压力保持恒定时,亨利定律也会发生变化。根据亨利定律,分压和摩尔分数成正比:
$$\mathrm{P_{gas}\:\varpropto\:X\:或}$$
$$\mathrm{P_{gas\:=\:KX}}$$
如果压力恒定,则方程式也会发生变化:
$$\mathrm{X\:\varpropto\:1/K}$$
即溶液的摩尔分数和亨利常数成反比。摩尔分数也与溶解度有关,因此亨利常数的增加会降低气体在流体中的溶解度。
$$\mathrm{k\:\varpropto\:1/溶解度}$$
亨利常数与温度的关系
气体在液体中的溶解是一个放热反应,即反应释放热量。因此,添加额外热量或升高温度会产生负面影响。温度和气体的溶解度成反比。即温度升高会降低气体在液体中的溶解度。数学上表示为:
$$\mathrm{T\:\varpropto\:1/溶解度}$$
但是
$$\mathrm{K\:\varpropto\:1/溶解度}$$
所以方程式变为:
$$\mathrm{t\:\varpropto\:K}$$
温度和亨利常数成正比。温度升高也会增加常数值。
影响亨利常数的因素
影响亨利常数值的一些因素包括:
系统的温度,温度升高会提高亨利常数值。
它取决于气体的性质,不同气体的值不同。
它取决于参与溶解的溶剂的性质。
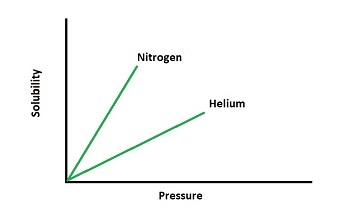
根据亨利定律,气体在液体溶液中溶解度与压力的关系图
气体的压力和溶解度成正比。根据亨利定律,压力对溶解度的影响因气体而异。下图显示了压力对溶解度的影响。
亨利定律的应用
该定律在现实生活中有很多应用,其中一些包括:
氧气的溶解有助于生活在分压较低的地区的人们呼吸。
软饮料,特别是碳酸饮料的生产,是基于该定律。
潜水员的呼吸是基于该定律。
该定律也解释了为什么海洋生物更喜欢在寒冷的环境中生活。
浓度为稀溶液的溶液服从亨利定律。
亨利定律的局限性
尽管它有很多应用,但也存在一些局限性,它们是:
只有当系统处于平衡状态时才适用。
它没有考虑气体在液体上溶解过程中发生的化学变化。
它取决于气体的性质,即不与液体反应或溶解度较小的气体。
需要特定的温度和压力才能验证该定律。
结论
亨利定律是重要的气体定律之一,在现实生活中有很多应用。根据该定律,一定气体在特定液体中,在固定体积和恒温下的溶解度直接等于处于平衡状态的气体和液体的分压。即气体在液体上的溶解度会随着温度和压力的变化而变化。压力升高会提高气体的溶解度,但温度升高会降低气体的溶解度。还存在其他一些方面,例如气体的特性、溶剂的特性等。尽管它解释了许多现象,但也有一些局限性。
常见问题
1. 哪些气体不服从亨利定律?
氨气和二氧化碳气体溶解在水中时不服从亨利定律。这是因为氨气和二氧化碳在水中的反应性。在这种情况下,它们的溶解度会很高。
2. 亨利定律与呼吸有什么关系?
发生在我们体内的呼吸过程可以用亨利定律来解释。即溶解在血液中的氧气量与肺泡中气体的分压直接相关。
3. 理想溶液是否服从亨利定律?
理想气体服从亨利定律,原因是理想气体的情况下,溶质-溶质和溶质-溶剂之间的关系是不同的。
4. 拉乌尔定律是什么?
拉乌尔定律断言,溶液的分压等于溶剂的摩尔分数与溶剂的分压的乘积。它涉及溶液。
5. 为什么氮气在血液中的溶解度高于氦气?
分压的比较可以解释这个过程,即氮气的分压比氦气高。根据亨利定律,溶解度和分压是相关的,因此氮气的溶解度高于氦气。这就是为什么在潜水时氧气瓶中使用氦气的原因。


 数据结构
数据结构 网络
网络 关系数据库管理系统(RDBMS)
关系数据库管理系统(RDBMS) 操作系统
操作系统 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C语言编程
C语言编程 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP