氧化和还原的区别
引言
氧化是反应过程中发生电子损失的过程。电子损失可以由分子、原子或任何离子完成。在氧化过程中,分子、原子或离子的氧化态增加。而还原是电子获得的过程。电子获得可以由分子、原子或任何离子完成。在还原过程中,分子、原子或离子的氧化态降低。氧化还原反应是一种氧化反应和还原反应的组合反应。在氧化还原反应中,反应物会改变其氧化态。在氧化还原反应中,氧化和还原反应同时发生。自身发生还原的试剂、元素或化合物称为氧化剂,自身发生氧化的试剂称为还原剂。
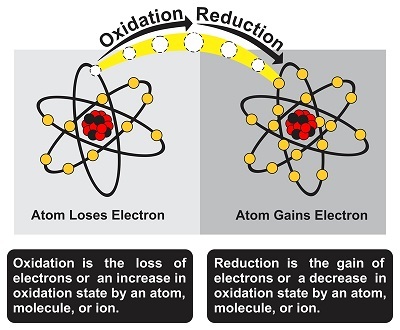
什么是氧化?
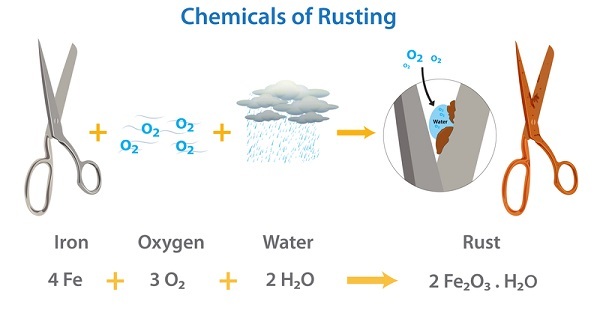
氧化是一个化学过程,其中由于添加氧分子,化学物质(反应物)的氧化态发生变化。它也可以定义为物质与氧分子 (O₂) 接触时发生的反应。参与反应的物质可能是金属和非金属,例如活组织。氧化是一个过程,其中在两个或多个元素相互作用的反应阶段会损失一个或多个电子。但在氧化反应中,并不一定需要氧气的参与。一个众所周知的氧化例子是铁在空气中的锈蚀。
什么是还原?
还原是一个与氧化反应正好相反的过程。根据经典概念,还原是一个涉及添加氢分子或任何其他电正性元素的过程。还原反应还涉及去除氧分子或任何其他电负性元素。还原是一个过程,其中在两个或多个元素相互作用的反应阶段会获得一个或多个电子。在还原反应中,分子、原子或离子的氧化态降低。同样,铁的锈蚀也是一个氧化还原反应的例子。在锈蚀过程中,氧气被还原,而铁被氧化。另一个例子是:氧化铁 (Fe₂O₃) 发生还原反应生成铁 (Fe),而一氧化碳 (CO) 发生氧化反应生成二氧化碳 (CO₂)。
$$Fe₂O₃\:+\:3CO\:\rightarrow\:2Fe\:+\:3CO₂$$
什么是氧化还原反应?
氧化还原反应只不过是氧化(失去电子)和还原(获得电子)反应的组合。由于氧化(失去电子)和还原(获得电子)反应同时发生。在氧化还原反应中,电子在参与反应的反应物之间转移。反应中的反应物会改变其氧化态 (O.S.)。氧化还原反应可以很容易地分为两个不同的过程,即氧化过程和还原过程。通过观察反应物质的氧化态 (O.S.) 的变化,可以观察到电子的 (e) 转移。氧化还原反应有各种类型,例如:化合反应 (𝐴 + 𝐵 → 𝐴𝐵)、分解反应 (AB → A + B)、置换反应 (X + YZ → XZ + Y) 和歧化反应。一些氧化还原反应的例子包括燃料燃烧、光合作用等。
什么是氧化剂?
在氧化还原反应中,自身被还原并氧化同一反应中存在的其他反应物的试剂或物质称为氧化剂。有时氧化剂也称为氧化剂或电子受体。换句话说,氧化剂是一种化学物质,它经历一种化学反应或反应,在该反应或反应中它获得或得到一个或多个电子 (e)。它是氧化还原反应的组分之一。氧化剂也可以被认为是一种化学物质,它将其电负性原子(通常是氧原子)转移或移动到底物。氧化剂的一个例子是二茂铁离子 (Fe(C₂H₅)₂⁺)。该离子容易接受电子 (e) 来形成 Fe(C₂H₅)₂。一种商业上使用的更强的受体是魔蓝。
什么是还原剂?
在氧化还原反应中,自身被氧化并还原同一反应中存在的其他反应物的元素或化合物称为还原剂。有时还原剂也称为还原剂或电子供体。换句话说,还原剂是一种化学物质,它经历一种化学反应或反应,在该反应或反应中它失去或离开一个或多个电子 (e)。它是氧化还原反应的重要组分之一。还原剂(自身被氧化)通常在其可能的较低或最低氧化态 (O.S.) 中被发现。在氧化还原反应中,氧化态增加的试剂或物质称为还原剂。一些众所周知的还原剂的例子包括甲酸、碱土金属、草酸等。
氧化还原反应中的氧化剂和还原剂
在氧化还原反应中,氧化剂是通过获取电子而发生还原的试剂或物质,因此其氧化态 (O.S.) 降低。而还原剂是通过捐赠电子而发生氧化的物质,因此其氧化态 (O.S.) 升高。氧化剂有助于氧化同一氧化还原反应中存在的另一种反应物,而还原剂有助于还原同一氧化还原反应中存在的另一种反应物。例如:
$$MnO₄⁻\:+\:SO₃²⁻\:\rightarrow\:Mn²⁺\:+\:SO₄²⁻$$
这里,MnO₄⁻ 是氧化剂,因为它正在减少。其氧化态 (O.S.) 从 +7 降低到 +2。而 SO₃²⁻ 是还原剂,因为它正在被氧化或增加。其氧化态 (O.S.) 从 +4 增加到 +6。
氧化和还原的区别
| 氧化 | 还原 |
|---|---|
| 氧化与电子损失有关。 | 还原与电子获得有关。 |
| 氧化意味着氧化数 (O.N.) 的增加或超过。 | 还原意味着氧化数 (O.N.) 的减少或降低。 |
| 在氧化过程中,化合物失去其氢原子。 | 在还原过程中,化合物获得氢原子。 |
| 在这个氧化反应中,会释放一定量的能量。 | 在这个还原反应中,能量会储存起来。 |
| 一些氧化剂的例子包括漂白剂和二茂铁离子。 | 一些还原剂的例子包括碱土金属和草酸。 |

结论
氧化是一个化学过程,涉及分子或化合物中电子的损失。通常,氧化与氧分子的添加和氢分子的去除有关。还原也是一个化学过程,它涉及化合物分子中一个或多个电子的获得。通常,还原与氢 (H₂) 的添加和氧分子的去除有关。氧化还原反应是氧化反应和还原反应的组合。在氧化还原反应中,氧化和还原同时发生。一种反应物发生氧化,而另一种反应物发生还原。
常见问题解答
1. 定义氧化
氧化是一个化学过程,其中化合物的电子损失和氧化态增加同时发生。氧化是氧化还原反应的组成部分。通常,氧化意味着氧的添加和氢的去除。
2. 给出一些还原剂的例子?
一些还原剂的例子包括碱土金属 (Mg、Ca)、甲酸、草酸等。这些金属能够被氧化并还原其他物质。
3. 定义氧化剂?
氧化剂是一种试剂或材料,它氧化与其在氧化还原反应中存在的其他反应物,并通过接受电子而自身被还原。
4. 给出一些氧化剂的例子?
一些氧化剂的例子包括卤素(如氟和氯)、漂白剂、过氧化氢等。
5. 给出一个氧化还原反应的例子,并说明反应中的氧化剂和还原剂?
在氧化还原反应 2Al + Fe₂O₃ → Al₂O₃ + 2Fe 中,Al 是还原剂,因为其氧化态从 0 增加到 +3,而 Fe₂O₃ 是氧化剂,因为其氧化态从 +3 降低到 0。


 数据结构
数据结构 网络
网络 关系数据库管理系统 (RDBMS)
关系数据库管理系统 (RDBMS) 操作系统
操作系统 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C语言编程
C语言编程 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP