极性与非极性之间的区别
简介
在两个相互连接的原子之间,极性键具有不相等数量的电子,而非极性键似乎具有相等比例的电子。如果不同和相似元素的原子结合,就会产生分子,但是当两个原子共享一对电子时,就会产生共价键。根据相关的电子如何在它们所结合的元素之间分配,原子之间的共价键被分类为极性或非极性。

什么是极性键?
极性键是一种共价键。当两种或多种元素的电负性差异大于0.4且小于1.8时,它们之间存在极性键。极性键不均匀地共享电子,因此电子的负电荷通常不会在整个分子中均匀分布。这导致偶极矩。当键的一端为正,另一端为负时,就会产生偶极矩。氢原子和氧原子之间的水键是极性键最著名的例子。由于明显的1.4的巨大电负性差异,这种键被归类为极性键。由于O原子电负性更强,H原子中的电子更倾向于O原子中的电子。
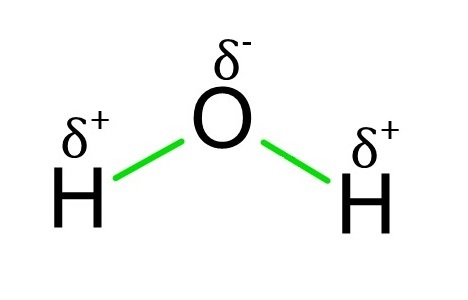
极性键的识别
如果分子的某一侧略带正电荷,而另一侧略带负电荷,则该分子为极性分子。这种键中的原子也可以贡献和放弃电子。因此,相对较近地保留电子的元素将比其他元素带负电荷更多。电负性是决定元素吸引电子的关键因素。电负性值将帮助您识别两个原子之间的键是极性键还是非极性键。当两个分子之间的电负性差异在0.4到1.8之间时,就会形成极性共价键。
什么是非极性键?
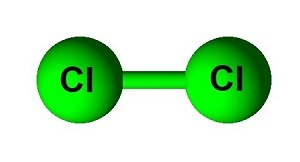
另一种共价键是非极性键。非极性键均匀地共享电子。非极性键是由两个或多个具有相同电负性或电负性差异小于0.4的元素形成的键。Cl2键是非极性键的一个例子。Cl2由两个氯原子组成。这两个原子之间的电负性差异为零,它们均匀地共享电子。
非极性键的识别
可以存在两种类型的键:纯极性键和非极性键。当原子电负性差异远小于0.4时,会形成非极性化学键;当它大于1.8时,会形成离子键。
极性与非极性
尽管一个分子可能包含极性共价键,但这并不一定是一个极性化合物。由于极性分子中存在总偶极矩,因此它们排列不均匀。以极性分子水为例。它们具有相当大的不可抵消的部分正电荷。另一方面,它可以交换整个电子并具有对称的极性键,这可以平衡某种类型的净偶极矩。以三氟化硼为例,其中极性键排列在一个平面上并相互中和。下表显示了这两种物质的区别:
| 极性 | 非极性 |
|---|---|
| 极性分子具有均匀的电子密度分布。 | 电子密度的不均匀分布导致非极性分子。 |
| 极性化合物的非对称排列 | 它们具有对称的极性键。 |
| 除非分子的偶极矩为0,否则该分子为极性分子。例如水。 | 非极性物质的偶极矩为零。例如,CCl₄。 |
极性化合物和非极性化合物之间的区别
| 极性化合物 | 非极性化合物 |
|---|---|
| 极性分子间相互作用是强力,导致形成氢键和偶极-偶极键。 | 最弱的力是构成伦敦色散力的非极性分子间力。 |
| 极性化合物存在净偶极矩。 | 非极性分子没有净偶极矩。 |
| 原子间的电负性差异 > 0.4。 | 原子间的电负性差异 < 0.4。 |
| 极性分子具有较高的熔点和沸点。 | 非极性化合物具有较低的熔点和沸点。 |
| 极性分子的蒸气压低。 | 非极性分子的蒸气压高。 |
| 极性化合物的表面张力强。 | 非极性化合物的表面张力低。 |
| 极性分子在结构上是不对称的,中心原子周围有孤对电子。 | 非极性分子是对称的,没有未共享电子。 |
| 极性分子包含一个或多个共价键。 | 并非所有非极性化合物都需要具有非极性共价键。 |
| 例如水、HF和CHCl₃。 | 戊烷、己烷和CO₂是一些例子。 |
结论
化学反应决定了原子和元素中键的极性。这也被称为两个电子甚至原子的共享。自然界中存在两种类型的共价键:极性和非极性。分子的电负性决定其极性或非极性。当一个或多个分子比其他分子更具电负性时,就会形成共价键、极性键和离子键。电子与负电荷的共享产生电偶极子。电偶极子是负电荷相对于正电荷的位移。
常见问题
1. 为什么极性物质不溶于非极性物质?
由于溶剂和溶质粒子之间相反电荷的明显吸引力,极性溶剂将溶解极性和离子溶质。虽然它们不能吸引偶极子和离子,但非极性溶剂只能溶解非极性溶质。
2. 分子能否形成极性键?
在极性键中,成键电子没有被均匀共享,导致键能。但是,根据其形状,分子可能是极性的也可能是非极性的。
3. 如果水不是极性的会怎样?
水将无法运输营养物质——无论是植物还是人体——也无法溶解和运输人体内的废物。人类将无法用盐来调味开水、汤和炖菜,因为它不会溶解在水中,从而不会带来额外的味道。
4. 极性物质和非极性物质哪种蒸发得更快?
更极性的化合物将更紧密地结合在一起,并且比极性较低的化合物蒸发得慢。由于它们彼此之间的吸引力较小,因此极性较低的分子可以快速蒸发。
5. 非极性分子能否穿过细胞膜?
因为像O₂和CO₂这样的小非极性分子可溶于脂质双层,所以它们可以很容易地穿过细胞膜。像H₂O这样的小的非极性分子可以穿过膜,而像葡萄糖这样的大得多的非极性分子则不能。


 数据结构
数据结构 网络
网络 关系数据库管理系统(RDBMS)
关系数据库管理系统(RDBMS) 操作系统
操作系统 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C语言编程
C语言编程 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP