
- UPSC IAS 预备考试化学笔记(第一部分)
- 化学 - 首页
- 我们周围的物质
- 我们周围的物质是纯净的吗
- 化学 - 原子与分子
- 化学 - 原子的结构
- 化学反应与方程式
- 化学 - 酸、碱和盐
- 材料:金属和非金属 I
- 化学 - 金属与非金属 II
- 碳及其化合物
- 元素的周期性分类
- 合成纤维和塑料
- 化学 - 煤和石油
- 化学 - 燃烧与火焰
化学 - 原子与分子
介绍
大约公元前 500 年,印度哲学家 महर्षि कणाद 首次提出了物质不可分割部分的概念,并将其命名为“pramanu”。
1808 年,约翰·道尔顿使用了“原子”一词,并提出了原子理论来研究物质。

道尔顿原子理论
根据道尔顿的原子理论,所有物质,无论是元素、化合物还是混合物,都由称为原子的微小粒子组成。
根据道尔顿的原子理论,所有物质,无论是元素、化合物还是混合物,都由称为原子的微小粒子组成。
道尔顿原子理论的显著特征
所有物质都是由称为原子的非常微小的粒子构成的。
原子是不可分割的粒子,在化学反应中既不能被创造也不能被破坏。
同一元素的所有原子在质量和化学性质上都相同,而不同元素的原子具有不同的质量和化学性质。
为了形成化合物,原子以小整数的比率结合。
在给定的化合物中,原子的相对数量和种类是恒定的。
原子质量
化学元素原子的质量;以原子质量单位(符号为u)表示。
原子质量大致相当于原子中质子和中子的数量。
一个原子质量单位是一个质量单位,等于碳-12原子质量的十二分之一(1/12),所有元素的相对原子质量都是相对于碳-12原子计算的。
分子
元素或化合物的最小粒子,能够独立存在并表现出相应物质的所有性质。
分子通常是由两个或多个以化学键结合在一起的原子组成的。
相同元素或不同元素的原子可以(通过化学键)结合在一起形成分子。
构成分子的原子数称为其原子数。
离子
带电粒子称为离子;它可以是负电荷或正电荷。
带正电荷的离子称为“阳离子”。
带负电荷的离子称为“阴离子”。
化学式
化合物的化学式表示其组成元素以及每种结合元素的原子数。
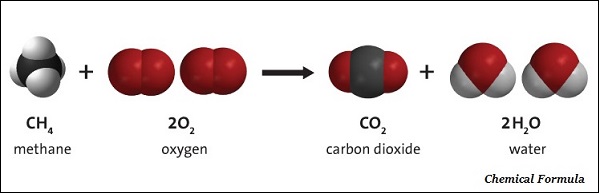
化合物的化学式是其组成的符号表示。
元素的结合能力称为其“化合价”。
分子质量
物质的分子质量是通过将相应物质分子中所有原子的原子质量加起来计算得到的。例如,水的分子质量计算如下:
氢的原子质量 = 1u
氧的原子质量 = 16 u
水包含两个氢原子和一个氧原子。
水的分子质量 = 2 × 1 + 1 × 16 = 18 u(u 是分子质量的符号)。
式量
物质的式量是通过将化合物式量单位中所有原子的原子质量加起来计算得到的。
阿伏加德罗常数或阿伏加德罗数
阿伏加德罗是一位意大利科学家,他提出了阿伏加德罗数(也称为阿伏加德罗常数)的概念。
1 摩尔任何物质中存在的粒子(原子、分子或离子)的数量是固定的,其值始终计算为6.022 × 1023。
1896 年,威廉·奥斯特瓦尔德引入了“摩尔”的概念;然而,摩尔单位于 1967 年被接受,以提供一种报告大量数字的简单方法。
质量守恒定律
在化学反应中,反应物和产物的质量总和保持不变,这被称为“质量守恒定律”。
定比定律
在纯净的化合物中,其元素总是以一定的质量比例存在,这被称为“定比定律”。