
- UPSC IAS 预备考试化学笔记(第一部分)
- 化学 - 首页
- 我们周围的物质
- 我们周围的物质是纯净的吗?
- 化学 - 原子与分子
- 化学 - 原子的结构
- 化学反应与方程式
- 化学 - 酸、碱和盐
- 材料:金属和非金属 I
- 化学 - 金属与非金属 II
- 碳及其化合物
- 元素的周期性分类
- 合成纤维和塑料
- 化学 - 煤和石油
- 化学 - 燃烧和火焰
化学 - 原子的结构
介绍
到1900年,人们发现原子并非简单的、不可分割的粒子,而是包含亚原子粒子。
J.J.汤姆逊发现了名为“电子”的亚原子粒子。

J.J.汤姆逊是第一个提出原子结构模型的人。
1886年,E.戈德斯坦在气体放电中发现了新的辐射,并将其命名为阴极射线。
通过阴极射线的实验发现了另一种带正电的亚原子粒子,并将其命名为质子。
汤姆逊原子模型
汤姆逊提出,原子由一个带正电的球体组成,电子(负电荷)嵌入其中(如下图所示)。
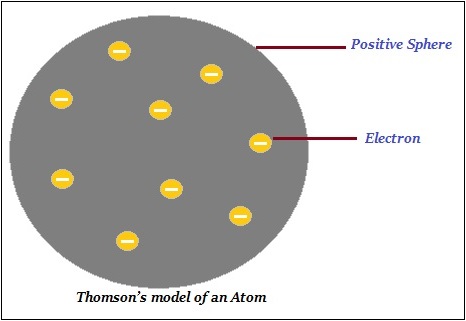
此外,汤姆逊说负电荷和正电荷在数量上相等。因此,原子整体上是电中性的。
卢瑟福原子模型
E.卢瑟福被誉为核物理学的“鼻祖”。

卢瑟福主要以其在放射性方面的研究以及通过金箔实验发现原子核而闻名(如下图所示)。
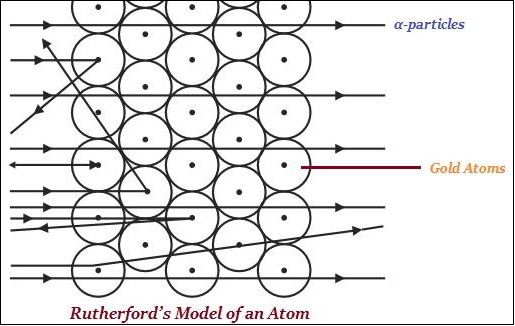
卢瑟福说,在一个原子中,存在一个带正电的中心,称为原子核。
卢瑟福说,几乎所有原子的质量都存在于原子核中。
根据卢瑟福的理论,电子在明确定义的轨道上绕原子核旋转。
玻尔原子模型
尼尔斯·玻尔进一步扩展了卢瑟福的模型,并改进了其不足之处。

根据玻尔的理论,原子内部只允许存在某些特殊的轨道,称为电子的离散轨道。
玻尔说,电子在离散轨道上旋转时不会辐射能量。
玻尔将轨道或壳层命名为能级(如下图所示)。
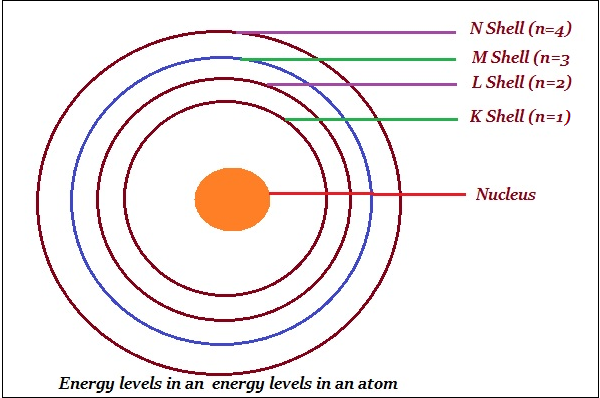
玻尔用字母 K、L、M、N……或数字 n = 1、2、3、4……表示这些轨道或壳层。
中子
1932年,J.查德威克发现了一种新的亚原子粒子,即中子。
中子不带电,质量几乎等于质子。
除氢原子外,所有原子的原子核中都存在中子。
电子分布在不同的轨道(壳层)
壳层中最多可以容纳的电子数由公式2n2给出。
‘n’是轨道数或能级指数,即 1、2、3……
根据给定的公式:
第一轨道,即K 壳层将是 = 2 × 12 = 2
第二轨道,即L 壳层将是 = 2 × 22 = 8
第三轨道,即M 壳层将是 = 2 × 32 = 18
第四轨道,即N 壳层将是 = 2 × 42 = 32
同样,最外层轨道最多可以容纳 8 个电子。
除非内层壳层已满,否则不会在给定的壳层中填充电子。这意味着壳层以逐步的方式填充;从内层壳层到外层壳层。
价电子
存在于原子最外层壳层的电子称为价电子。
根据玻尔-伯里模型,原子的最外层壳层最多可以有 8 个电子。
原子序数
原子核中质子的总数称为原子序数。
原子的质子数决定了原子序数。
原子序数用‘Z’表示。
质子和中子统称为核子。
质量数
原子核中质子和中子总数之和称为质量数。
同位素
具有相同原子序数但质量数不同的同一种元素的原子称为同位素。例如,氢原子有三种同位素:氕、氘和氚。
原子的同位素的化学性质相似,但物理性质不同。
同量异位素
具有不同原子序数但质量数相同的不同元素的原子称为同量异位素。例如,钙的原子序数为 20,氩的原子序数为 18;此外,这些原子中的电子数不同,但这两个元素的质量数均为 40。